16、(14分)下表为元素周期表的一部分,请参照元素①-⑧在表中的位置,用化学用语回答下列问题:
|
族 周期 |
IA |
|
0 |
|||||
|
1 |
① |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
|
|
2 |
|
|
|
② |
③ |
④ |
|
|
|
3 |
⑤ |
|
⑥ |
⑦ |
|
|
⑧ |
|
(1)④、⑤、⑥的原子半径由大到小的顺序为_________________________。
(2)②、③、⑦的最高价含氧酸的酸性由强到弱的顺序是_________________________。
(3)①、④、⑤、⑧中的某些元素可形成既含离子键又含极性共价键的化合物,写出其中一种化合物的电子式:____________________。
(4)由表中两种元素的原子按1:1组成的常见液态化合物的稀液易被催化分解,可使用的催化剂为(填序号)_________________。
a.MnO2 b.FeCl3 c.Na2SO3 d.KMnO4
(5)由表中元素形成的常见物质X、Y、Z、M、N可发生以下反应:
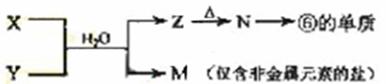
X溶液与Y溶液反应的离子方程式为__________________ ___,
N→⑥的单质的化学方程式为____________ _。
常温下,为使0.1 mol/L M 溶液中由M电离的阴、阳离子浓度相等,应向溶液中加入一定量的Y溶液至_________________。
15、某学生用NaHCO3和KHCO3组成的某混合物进行实验,测得如下数据(盐酸的物质的浓度相等)。则下列分析推理中不正确的是
|
|
50mL盐酸 |
50mL盐酸 |
50Ml盐酸 |
|
m(混合物) |
9.2g |
15.7g |
27.6g |
|
V(CO2)(标况) |
2.24L |
3.36L |
3.36L |
A、盐酸的物质的量浓度为3.0 mol/L
B、根据表中数据能计算出混合物中NaHCO3的质量分数
C、加入混合物9.2 g时盐酸过量
D、15.7 g混合物恰好与盐酸完全反应
第二卷 非选择题( 55分)
8.下表中评价合理的是
|
选项 |
化学反应及离子方程式 |
评价 |
|
A |
Fe3O4与稀硝酸反应:2Fe3O4 + 18H+ = 6Fe3+
+H2↑ +8H2O |
正确 |
|
B |
向碳酸镁中加入稀盐酸:CO32- + 2H+ = CO2↑ + H2O |
错误,碳酸镁不应写成离子形式 |
|
C |
向硫酸铵溶液中加入氢氧化钡溶液:Ba2+ + SO42-=BaSO4↓ |
正确 |
|
D |
FeBr2溶液与等物质的量的Cl2反应: 2Fe2+ + 2Br- + 2Cl- = 2Fe3+ + 4Cl- + Br2 |
错误,Fe2+与Br-的化学计量数之比应为1:2 |
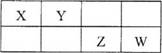 右表是元素周期表的一部分。X、Y、Z、W均为短周期元素,Z元素原子最外层电子数与电子总数之比为3:8。下列说法不正确的是
右表是元素周期表的一部分。X、Y、Z、W均为短周期元素,Z元素原子最外层电子数与电子总数之比为3:8。下列说法不正确的是