22.(10分)某学生课外兴趣小组为了测定镁铝合金中铝的含量,进行了如下实验。将合金3.0克投入足量的100 mL 1.5 mol•L-1烧碱溶液中,充分反应后分离出未反应的镁,然后在溶液中滴加1.0 mol•L-1盐酸,加入盐酸的体积与得到沉淀的数据如下表:
|
实验次数 |
加入盐酸的体积 |
沉淀质量 |
|
1 |
60
mL |
0 |
|
2 |
80
mL |
0.78g |
|
3 |
180
mL |
5.46g |
(1)从开始加入盐酸到生成最大量沉淀,溶液中发生反应的离子方程式依次为:
。
(2)开始沉淀时加入的盐酸体积必须大于 mL,若得到沉淀的量最大时,加入的盐酸体积为 mL。
(3)合金中铝的质量分数为 。
21.(9分)已知金属镁与氯化铁和氯化铜溶液反应有多种实验假设。甲、乙两位同学分别设计合理实验步骤探究该反应的历程。
提出猜想:
甲:推测镁与氯化铁、氯化铜水解产生的H+反应,拉动水解平衡生成H2。
乙:推测镁与氯化铁、氯化铜发生氧化还原反应。
结合对试剂的选择两位同学做了如下实验:
实验过程:
|
编号 |
实验操作 |
预期现象和结论 |
|
① |
将打磨过的镁条取加入经盐酸酸化的饱和氯化铁溶液,充分反应 |
始终有大量气泡,颜色无明显变化,未见沉淀生成,反应完全后取出镁条,发现可被磁铁吸引 |
|
② |
将打磨过的镁条取加入0.1mol/L氯化铁溶液,充分反应 |
有少量气泡,颜色变浅,有红褐色沉淀生成,反应完全后取出镁条,发现不能被磁铁吸引 |
根据实验操作,实验现象,甲、乙再分别推测解释相应的结论。
(1)与甲同学的推测不尽符合的现象是 , 。
在实验①②的基础上甲进一步提出猜测:镁与H+反应拉动饱和氯化铁的水解平衡生成Fe(OH)3胶体,故未看到沉淀现象。
要验证甲的进一步猜想,还须补做的实验是 。
提出你的猜想 。
(2)乙:根据实验②可推测 。
(3)结合甲,乙两位同学的推测,你能否谈谈对上述实验事实的认识:
。
19.(10分)某试剂厂用银(含杂质铜)和硝酸(含Fe3+)反应制取硝酸银,步骤如下:
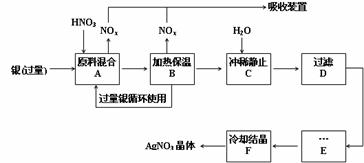
(1)工业上一般选用中等浓度的硝酸和银反应来制取硝酸银。请在下表空格处填空。
|
|
优点 |
缺点 |
|
使用浓硝酸 |
反应速率快 |
酸耗较大,产生NOx的量较多 |
|
使用稀硝酸 |
|
|
(2)步骤B加热保温的作用是 。
a. 有利于加快反应速率
b.有利于未反应的硝酸挥发
c.有利于硝酸充分反应,降低溶液中H+的浓度
(3)步骤C加入适量水冲稀的目的是为了除去Fe3+、Cu2+等杂质,冲稀时产生沉淀的原因是 。
(4)步骤E进行的操作是 。
(5)制得的硝酸银中含有少量硝酸铜,通常除去硝酸铜的方法是在步骤E之前加适量新制的Ag2O,使Cu2+转化为Cu(OH)2沉淀,反应后过滤除去。该反应的化学方程式为: 。
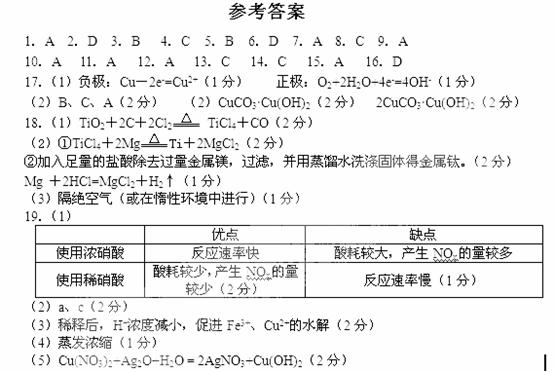
(7分)以下框图中A→M是中学化学中常见的物质,其中A、E是金属,F和J为气体单质,其余均为化合物或其溶液,C为淡黄色固体,D为红棕色粉末,M为红褐色固体。

请回答下列问题:
(1)C的电子式是 ,I溶液的焰色反应呈 色。
(2)若将H溶液加热蒸干、灼烧,最终得到的固体物质的化学式: 。
(3)写出①反应的离子方程式: 。
(4)写出②反应的化学方程式: 。
 (1)
(1)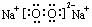 (1分) 黄色(1分) (2)Fe2O3 (1分)
(1分) 黄色(1分) (2)Fe2O3 (1分) 
 2CuO+CO2↑+(x+1)H2O。现取该碱式碳酸铜样品,进行测量该样品(粉末)组成中碳的质量分数和结晶水x的值的实验。
2CuO+CO2↑+(x+1)H2O。现取该碱式碳酸铜样品,进行测量该样品(粉末)组成中碳的质量分数和结晶水x的值的实验。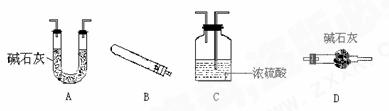

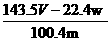 ×100%
×100%