21.(10分)(1 )已知:在常温下,浓度均为0.1mol·L-1的下列六种溶液的pH:
)已知:在常温下,浓度均为0.1mol·L-1的下列六种溶液的pH:
|
溶质 |
CH3COONa |
NaHCO3 |
Na2CO3 |
NaClO |
NaCN |
C6H5ONa |
|
pH |
8.8 |
9.7 |
11.6 |
10.3 |
11.1 |
11.3 |
依据复分解反应的规律,请你判断下列反应不能成立的是 (填编号)。
A.CH3COOH+ Na2CO3=NaHCO3+CH3CO ONa
ONa
B.CH3COOH+NaCN=CH3COONa+HCN
C.CO2+H2O+2NaClO=Na2CO3+2HClO
D.CO2+H2O+2C6H5ONa=Na2CO3+2C6H5OH
(2)根据前面描述的信息判断,浓度均为0.05mol·L-1的下列六种物质的溶液中,pH最小的是 (填编号);将各溶液分别稀释100倍,pH变化最小的是 (填编号)。
①C6H5OH ②CH3COOH ③HCN ④HClO ⑤H2SO4 ⑥HClO4
(3)根据前述信息,写出将过量的氯气通入到少量的碳酸钠溶液中反应的离子 方程式:
。
方程式:
。
(4)标准状况下,向1L含NaOH、Ca(OH)2各0.1 mol的溶液中不断通入CO2至过量,请画出产生的沉淀的物质的量(mol)随CO2通入体积(L)的变化趋势图。
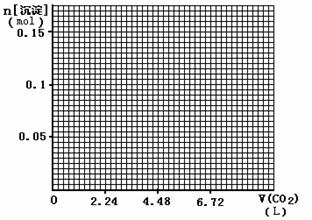
20.(10分)由几种离子化合物组成的混合物,含有以下离子中的若干种:K+、NH4+、Mg2 +、Cu2+、Ba2+、C1-、SO42-、CO32-。将该混合物溶于水后得无色澄清溶液,现分别取3份100mL该溶液进行如下实验:
+、Cu2+、Ba2+、C1-、SO42-、CO32-。将该混合物溶于水后得无色澄清溶液,现分别取3份100mL该溶液进行如下实验:
|
实验序号 |
实验内容 |
实验结果 |
|
a |
加AgNO3溶液 |
有白色沉淀生成 |
|
b |
加足量NaOH溶液并加热 |
收集到气体1.12L(已折算成标准 状况下的体积) |
|
c |
加足量BaC 12溶液时,对所得沉淀进行洗涤、干燥、称量;再向沉淀中加足量稀盐酸,然后干燥、称量 12溶液时,对所得沉淀进行洗涤、干燥、称量;再向沉淀中加足量稀盐酸,然后干燥、称量 |
第一次称量读数为6. 27g,第二次 称量读数为2.33g |
试 回答下列问题:
回答下列问题:
(1)该混合物中一定不存在的离子是 。
(2)试写出实验b发生反应的离子方程式 。
(3)溶液中一定存在的阴离子及其物质的量浓度(可不填满):
|
阴离子符号 |
物质的量浓度(mol·L-1) |
|
|
|
|
|
|
|
|
|
(4)判断混合物中是否存在K+并说明理由? 。
 加点的物质在化学反应中完全消耗的是
加点的物质在化学反应中完全消耗的是
 。
。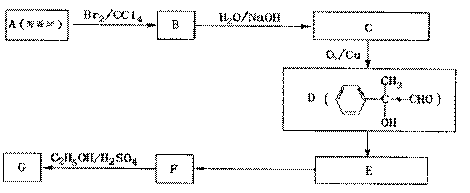

 请根据上面流程,回答以下问题:
请根据上面流程,回答以下问题: 2SO3(g) △H=-196.6 KJ·mol- 1)
2SO3(g) △H=-196.6 KJ·mol- 1)

 与时间t的关系如图2所示,若不改变SO2 (g)和O 2 (g)的量,则图中t4时引起平衡
与时间t的关系如图2所示,若不改变SO2 (g)和O 2 (g)的量,则图中t4时引起平衡