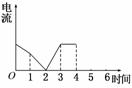
0 42044 42052 42058 42062 42068 42070 42074 42080 42082 42088 42094 42098 42100 42104 42110 42112 42118 42122 42124 42128 42130 42134 42136 42138 42139 42140 42142 42143 42144 42146 42148 42152 42154 42158 42160 42164 42170 42172 42178 42182 42184 42188 42194 42200 42202 42208 42212 42214 42220 42224 42230 42238 447348
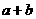 ;
;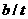
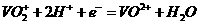
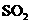 的起始浓度为(a+b)mol/L.
的起始浓度为(a+b)mol/L.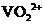 生成
生成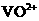 ,V的化合价从+5降低为+4,得一个电子,0 原子减少,从图中知,其中
,V的化合价从+5降低为+4,得一个电子,0 原子减少,从图中知,其中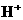 发生了移动,参与反应,由此写成电极反应式.②作为原电池,左槽得电子,而右槽失电子.充电作为电解池处理,有槽中则为得电子,对应化合价降低,即为
发生了移动,参与反应,由此写成电极反应式.②作为原电池,左槽得电子,而右槽失电子.充电作为电解池处理,有槽中则为得电子,对应化合价降低,即为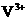 生成
生成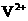 ,颜色由绿生成紫.③由电极反应式知,
,颜色由绿生成紫.③由电极反应式知, /6.02×
/6.02×