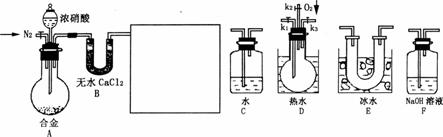
19.(1)工业上以粗铜为原料采取如图所示流程制备硝酸铜晶体:
 ①在步骤a中,还需要通入氧气和水,其目的是 。
②在保温去铁的过程中,为使Fe3+沉淀完全,可以向溶液中加入CuO,调节溶液的pH,根据下表数据,溶液的pH应保持在 范围。
①在步骤a中,还需要通入氧气和水,其目的是 。
②在保温去铁的过程中,为使Fe3+沉淀完全,可以向溶液中加入CuO,调节溶液的pH,根据下表数据,溶液的pH应保持在 范围。
|
|
氢氧化物开始沉淀时的pH |
氢氧化物沉淀完全时的pH |
|
Fe3+
Cu2+ |
1.9
4.7 |
3.2
6.7 |
不用加水的方法调节溶液pH的原因是 。
③进行蒸发浓缩时,要用硝酸调节溶液的pH=1,其目的是(结合离子方程式说明) 。
(2)工业上常利用硝酸铜溶液电镀铜,电镀时阴极的电极反应式是 。
 (3)下图是某小组同学查阅资料所绘出的硝酸铜晶体[ Cu(NO3)2·nH2O
]的溶解度曲线(温度在30℃前后对应不同的晶体),下列说法正确的是 (填字母)。
a. A点时的溶液为不饱和溶液
b. B点时两种晶体可以共存
c.按上述流程最终得到的晶体是
(3)下图是某小组同学查阅资料所绘出的硝酸铜晶体[ Cu(NO3)2·nH2O
]的溶解度曲线(温度在30℃前后对应不同的晶体),下列说法正确的是 (填字母)。
a. A点时的溶液为不饱和溶液
b. B点时两种晶体可以共存
c.按上述流程最终得到的晶体是
Cu(NO3)2·3H2O d.若将C点时的溶液降温至 30℃以下,
可以析出Cu(NO3)2·6H2O晶体
(4)某些共价化合物(如H2O、NH3、N2O4等)在液态时有微弱的导电性,主要是因为发生了电离,如:2NH3 NH4++NH2-,由此制备无水硝酸铜的方法之一是用Cu与液态N2O4反应。液态N2O4电离得到的两种离子所含电子数相差18,则液态N2O4电离的方程式是 ;Cu与液态N2O4反应制得无水硝酸铜的化学方程式是 。
NH4++NH2-,由此制备无水硝酸铜的方法之一是用Cu与液态N2O4反应。液态N2O4电离得到的两种离子所含电子数相差18,则液态N2O4电离的方程式是 ;Cu与液态N2O4反应制得无水硝酸铜的化学方程式是 。
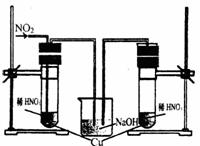
17.已知粗铜中含有少量的锌、铁、银、金等金属和少量矿物杂质(杂质与酸不反应)。某化学兴趣小组在实验室条件下以硫酸铜溶液为电解液,用电解的方法实现了粗铜的提纯,并对阳极泥和电解液中金属进行回收和含量测定。
步骤一:电解精制:
电解时,粗铜应与电源的 极相连,阴极上的电极反应式为 。电解过程中,硫酸铜的浓度会 (选填:变大、不变、变小)。
步骤二:电解完成后,该小组同学按以下流程对电解液进行处理:

(1)阳极泥的综合利用:
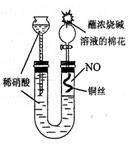
稀硝酸处理阳极泥得到硝酸银稀溶液,该步反应的离子方程式为 。残渣含有极少量的黄金。为了回收金,他们查阅了有关资料(见下表):
|
序号 |
反应 |
化学平衡常数 |
|
1 |
Au + 6HNO3(浓) Au(NO3)3 + 3NO2↑+ 3H2O Au(NO3)3 + 3NO2↑+ 3H2O |
<< 1 |
|
2 |
Au3+
+ 4Cl- = AuCl4- |
>>1 |
从资料中可知,金很难与硝酸反应,但却可溶于王水(浓硝酸与盐酸按体积比1∶3的混合物),请你从化学平衡移动的角度简要解释金能够溶于王水的原因 。
(2)滤液含量的测定:以下是该小组探究滤液的一个实验流程:

则100mL滤液中Cu2+ 的浓度为 mol·L-1 ,Fe2+的浓度为 _________________mol·L-1。
 CH3OH(g)+H2O(g) △H3
CH3OH(g)+H2O(g) △H3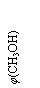

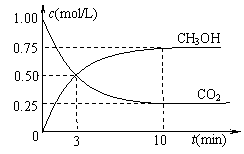 A.第10 min后,向该容器中再充入1 mol CO2和3 mol H2,则再次达到平衡时c(CH3OH)=1.5
mol/L
A.第10 min后,向该容器中再充入1 mol CO2和3 mol H2,则再次达到平衡时c(CH3OH)=1.5
mol/L ③直接甲醇燃料电池结构如右下图所示。其工作时负极电极反应式可表示为 。
③直接甲醇燃料电池结构如右下图所示。其工作时负极电极反应式可表示为 。
 表示共用电子对由N原子单方面提供),白磷(P4)的结构式为
表示共用电子对由N原子单方面提供),白磷(P4)的结构式为
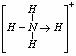
 。科学家在液氨中加入氢氧化铯(CsOH)和特殊的吸水剂,使液氨中的NH4+生成N4分子,请写出液氨与氢氧化铯反应的化学方程式:_________________;
。科学家在液氨中加入氢氧化铯(CsOH)和特殊的吸水剂,使液氨中的NH4+生成N4分子,请写出液氨与氢氧化铯反应的化学方程式:_________________;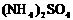 和NH3·H2O的水溶液称为“缓冲溶液”,在此溶液中加入少量的强碱或强酸时,溶液的pH几乎不变,这可由下列离子方程式来说明。
和NH3·H2O的水溶液称为“缓冲溶液”,在此溶液中加入少量的强碱或强酸时,溶液的pH几乎不变,这可由下列离子方程式来说明。 ;
;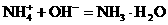
 和
和 的大量存在,加少量酸或碱时,溶液中
的大量存在,加少量酸或碱时,溶液中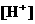 与
与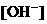 基本保持不变;
基本保持不变;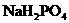 和
和 的溶液,也具有缓冲作用,写出此溶液中加入少量强酸或强碱时发生的离子反应方程式:
的溶液,也具有缓冲作用,写出此溶液中加入少量强酸或强碱时发生的离子反应方程式: