网址:http://m.1010jiajiao.com/timu3_id_421414[举报]
 工业上利用N2和H2可以合成NH3,NH3又可以进一步制备联氨(N2H4)等.
工业上利用N2和H2可以合成NH3,NH3又可以进一步制备联氨(N2H4)等.(1)①.火箭常用N2H4作燃料,N2O4作氧化剂.1mol联氨完全反应转移
②.已知:N2(g)+2O2(g)=2NO2(g)△H=+67.7kJ/mol
N2H4(g)+O2(g)=N2(g)+2H2O(g)△H=-534.0kJ/mol
NO2(g)?1/2N2O4(g)△H=-26.35kJ/mol
试写出气态联氨在气态四氧化二氮中燃烧生成氮气和气态水的热化学方程式:
(2)联氨--空气燃料电池是一种碱性燃料电池,电解质溶液是20%~30%的氢氧化钾溶液.写出该电池正极的电极反应式
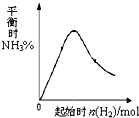
(3)在300℃时,改变起始反应物中氢气的物质的量对反应.N2(g)+3H2(g)?2NH3(g)△H<0的影响如图所示.请在图中画出400℃时对应的图象.
SiO2(s)+4HF(g) ![]() SiF4(g)+2H2O(g)?ΔH(298.15 K)=-94.0 kJ·mol-1?
SiF4(g)+2H2O(g)?ΔH(298.15 K)=-94.0 kJ·mol-1?
ΔS(298.15 K)=-75.8 J·mol-1·K-1?
设ΔH和ΔS不随温度而变化,试求此反应自发进行的温度条件。????????????
查看习题详情和答案>>光气(COCl2)在塑料、制革、制药等工业中有许多用途,工业上采用高温下CO与Cl2在活性炭催化下合成。
COCl2的分解反应为COCl2(g)  Cl2(g) + CO(g) △H =" +" 108 KJ·mol-1。反应体系达到平衡后,各物质的浓度在不同条件下的变化状况如下图所示(第10 min到14 min的COCl2浓度变化曲线未画出):
Cl2(g) + CO(g) △H =" +" 108 KJ·mol-1。反应体系达到平衡后,各物质的浓度在不同条件下的变化状况如下图所示(第10 min到14 min的COCl2浓度变化曲线未画出):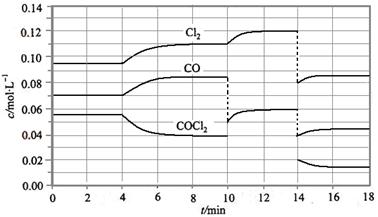
(1) 计算反应在第8 min 时的平衡常数K = ;
(2) 比较第2 min 反应温度T(2)与第8 min反应温度T(8)的高低:T(2) T(8)(填“<”、“>”或“=”);
(3) 若12 min 时反应于温度T(8)下重新达到平衡,则此时c(COCl2) = mol·l-1;
(4) 比较产物CO在2~3 min、5~6 min和12~13 min时平均反应速率[平均反应速率分别以v(2~3)、v(5~6)、v(12~13)表示]的大小 ;
(5)比较反应物COCl2在5~6 min和15~16 min时平均反应速率的大小v(5~6) v(12~13) (填“<”、“>”或“=”),原因是 。
光气(COCl2)在塑料、制革、制药等工业中有许多用途,工业上采用高温下CO与Cl2在活性炭催化下合成。
已知COCl2(g)  Cl2(g)+CO(g) ΔH=+108 kJ·mol-1。反应体系达到平衡后,各物质的浓度在不同条件下的变化状况如下图所示(第10 min到14 min的COCl2浓度变化曲线未示出):
Cl2(g)+CO(g) ΔH=+108 kJ·mol-1。反应体系达到平衡后,各物质的浓度在不同条件下的变化状况如下图所示(第10 min到14 min的COCl2浓度变化曲线未示出):

(1)化学平衡常数表达式K=________,计算反应在第8 min时的平衡常数K=________;
(2)比较第2 min反应温度T(2)与第8 min反应温度T(8)的高低:T(2)________T(8)(填“<”、“>”或“=”);
(3)若12 min时反应于温度T(8)下重新达到平衡,则此时c(COCl2)=________;10~12 min内CO的平均反应速率为v(CO)=________;
(4)比较产物CO在2~3min、5~6min和12~13min时平均反应速率(平均反应速率分别以v(2~3)、v(5~6)、v(12~13))的大小________________。
查看习题详情和答案>>