网址:http://m.1010jiajiao.com/timu3_id_421411[举报]
现代工业将煤炭气化,既可以提高燃料的利用率、减少CO、SO2,等的排放,又可以扩大水煤气的广泛用途
(1) 已知:
则反应=_______,(用含
的代数式表示)
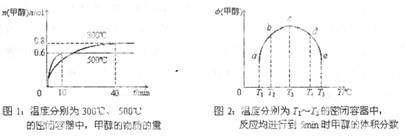
(2) CO和H2在一定条件下合成甲醇的反应为:ΔH3 。向容积均为1L的a, b、c、d、e五个密闭容器中分别充入1mol CO和2mol H2的混合气体,控温,进行实验,测得相关数据如下图1和图2。
①该反应的_______O (选填“<”、“>”或“=”)。
②对图2进行分析,从a到c段曲线变化特点看,温度升高甲醇体积分数增高的原因可能是:______________将容器c中的平衡状态转变到容器d中的平衡状态,可采取的措施有_______
(3)某燃料电池以CO为燃料,以空气为氧化剂,以熔融态K2CO3为电解质。写出该燃料电池负极的电极反应式_______。
查看习题详情和答案>>
现代工业将煤炭气化,既可以提高燃料的利用率、减少CO、SO2,等的排放,又可以扩大水煤气的广泛用途
(1) 已知: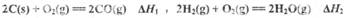
则反应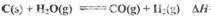 =_______,(用含
=_______,(用含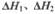 的代数式表示)
的代数式表示)
(2) CO和H2在一定条件下合成甲醇的反应为: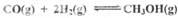 ΔH3 。向容积均为1L的a, b、c、d、e五个密闭容器中分别充入1mol CO和2mol H2的混合气体,控温,进行实验,测得相关数据如下图1和图2。
ΔH3 。向容积均为1L的a, b、c、d、e五个密闭容器中分别充入1mol CO和2mol H2的混合气体,控温,进行实验,测得相关数据如下图1和图2。
①该反应的 _______O (选填“<”、“>”或“=”)。
_______O (选填“<”、“>”或“=”)。
②对图2进行分析,从a到c段曲线变化特点看,温度升高甲醇体积分数增高的原因可能是:______________将容器c中的平衡状态转变到容器d中的平衡状态,可采取的措施有_______
(3)某燃料电池以CO为燃料,以空气为氧化剂,以熔融态K2CO3为电解质。写出该燃料电池负极的电极反应式_______。
查看习题详情和答案>>
 电解高铁酸盐(如K2FeO4)是一种高效绿色氧化剂,可用于废水和生活用水的处理.从环境保护的角度看,制备高铁酸盐较好的方法为电解法:Fe+2NaOH+2H2O═Na2FeO4+H2↑.
电解高铁酸盐(如K2FeO4)是一种高效绿色氧化剂,可用于废水和生活用水的处理.从环境保护的角度看,制备高铁酸盐较好的方法为电解法:Fe+2NaOH+2H2O═Na2FeO4+H2↑.(1)采用铁片作阳极,NaOH溶液为电解质溶液,电解制备高铁酸钠,其电流效率可达到40%.写出阳极的电极反应式:
(2)铁丝网电极是更理想的阳极材料,相同条件下,可将电流效率提高至70%以上,原因是
(3)FeO42-易与水反应生成絮状氢氧化铁,也会影响高铁酸盐的产率.若以铁丝网为阳极,在中间环节(对应图1中4h后)过滤掉氢氧化铁,合成过程中FeO42-浓度以及电流效率随时间的变化如图1中实线所示(图中曲线是每隔1h测得的数据).图中虚线部分对应于没有过滤氢氧化铁而连续电解的情况.下列判断正确的是
A.过滤掉氢氧化铁有利于获得较高浓度的高铁酸盐溶液
B.过滤掉氢氧化铁对电流效率影响不大
C.实验表明氢氧化铁的存在影响高铁酸盐浓度的增加
D.实验表明不过滤掉氢氧化铁,6h后电流效率几乎为0
(4)碱性条件下,高铁酸盐的稳定性与温度有关(如图2).随温度升高,高铁酸盐产率先增大后减小的原因是

(5)人们还对用铁的氧化物作电极制备高铁酸盐进行了研究,例如以磁铁矿多孔电极制备高铁酸盐,该研究方向的价值在于
A.将1mol Fe3O4氧化成高铁酸盐需10/3mol电子,可提高电流效率
B.以铁的氧化物为电极,可以实现变废(Fe3O4或铁锈)为宝(高铁酸盐)
C.自然界几乎没有铁单质,而有大量磁铁矿,该方法的原料来源广泛
D.磁铁矿作为多孔电极不会出现钝化现象.