网址:http://m.1010jiajiao.com/timu3_id_420324[举报]
大气为地球上各种生物的生存提供了条件。但是,随着工业和交通运输迅速发展,城市人口高度集中,人类向大气中大量排放烟尘和有害气体等,正在对大气造成污染。我国某工业城市的“空气质量日报”显示,该城市的空气受到一定程度的污染。某研究性学习小组对该城市的空气污染进行了下列研究。
(1)小组内一同学初步分析得出,该城市空气污染的主要原因有
A.使用石油液化气
B.燃烧含硫煤
C.粉尘污染三个。另一同学认为还有一个不可排除的原因是:
D.______________________________________。
研究性学习小组就造成该城市空气污染的最主要原因调查了该市100名市民和100位环保部门人士。调查结果如下图所示:
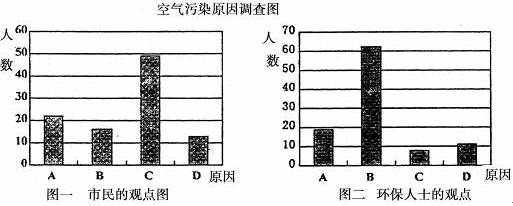
(1)从环保人士的观点上分析,你认为造成该城市空气污染的主要有害成分是____________(用化学式表示)。
(2)空气污染易形成酸雨。研究性学习小组对该城市的雨水进行了采样与分析,刚采集时测得pH为4.82,放在烧杯中经2 h后,再次测得pH为4.68。对此,你的合理解释是________。
(3)研究性学习小组同学取空气(含氮气、氧气、二氧化碳、二氧化硫等)10.0 L(已折算成标准状况),缓慢通过足量溴水,在所得溶液中加入过量的氯化钡溶液,产生白色沉淀,将沉淀洗涤、干燥,称得其质量为0.0233g。试回答该白色沉淀的化学式为____________,通过计算得该空气中主要有害气体成分的体积分数为______________。
(4)该小组同学提出下列措施以减少空气污染的主要有害成分排放量,你认为合理的是____________ (填序号)。
①用天然气代替煤炭做民用燃料 ②改进燃煤技术,减少煤的用量
③工厂生产时将燃煤锅炉的烟囱造得更高 ④燃煤中加入适量石灰石后使用
查看习题详情和答案>>研究化学反应原理对生产生活很有意义,请用化学反应原理的相关知识回答下列问题:
(1)用铅蓄电池电解甲、乙两电解池中的溶液。已知铅蓄电池的总反应为:Pb(s)+PbO2(s)+2H2SO4(aq)2PbSO4(s)+2H2O(1)。电解一段时间后,向c极和d极附近分别滴加酚酞试剂,c极附近溶液变红,下列说法正确的是____________
(填写序号)
A.d极为阴极
B.若利用甲池精炼铜,b极应为粗铜
C.放电时铅蓄电池负极的电极反应式为:
PbO2(s)+4H+(aq)+(aq)+4e-
PbSO4(s)+2H2O(1)
D.若四个电极材料均为石墨,当析出6.4g Cu时,两池中共产生气体3.36L(标准
状况下)
(2)某二元酸H2A在水中的电离方程式是:H2A=H++HA-;HA-H++A2-,请回答下列问题:
①Na2A溶液显_________(填“酸性”、“中性”或“碱性”),理由是________________
(用离子方程式表示)。
②已知0.1mol·L-1的NaHA溶液的pH=2,则0.1mol·L-1的H2A溶液中氢离子的物质的量浓度可能是__________0.1lmol·L-1(填“<”、“>”或“=”),理由是:___________________________.
(3)二甲醚是一种重要的清洁燃料,利用水煤气合成二甲醚的三步反应如下:
①2H2(g)+CO(g)CH3OH(g); △H=-90.8kJ·mol-1
②2CH3OH(g)CH3OCH3(g)+H2O(g);△H=-23.5kJ·mol-1
③CO(g)+H2O(g)CO2(g)+H2(g);△=-41.3kJ·mol-1
写出水煤气直接合成二甲醚同时生成CO2的热化学反应方程式___________________.
(4)SO2是硫酸生产的重要中间产物,也是空气污染的主要原因之一,其氧化生成SO3的反应为:2SO2(g)+O2(g)2SO3(g)。在一定温度下,将0.23 molSO2和0.11 mol氧气放入容积为l L的密闭容器中发生反应,达到平衡后得到0.12 mol SO3,则反应的平衡常数K=________。若温度不变,再加入0.50mol氧气后重新达到平衡,则SO3的体积分数将___________(填“增大”、“不变”或“减小”)。
查看习题详情和答案>>
CO2是目前大气中含量最高的一种温室气体。因此,控制和治理CO2是解决温室效应的有效途径。
(1)下列关于CO2的说法正确的是(填序号)_________。
①减少化石燃料的使用,充分利用太阳能、风能等清洁能源可有效降低大气中CO2的含量
②植树造林,增大植被面积可以有效降低大气中CO2的含量
③二氧化硫、氮氧化物、二氧化碳、悬浮微粒的含量都是空气质量日报的内容
④空气中CO2的含量过高会导致酸雨的形成
(2)下列措施不能减少二氧化碳排放的是(填序号) _________。
①利用太阳能制氢
②关停小火电企业
③举行“地球一小时”熄灯活动
④推广使用煤液化技术
(3)下列反应不产生温室气体的是(填序号)_________。
①用纯碱制玻璃 ②用煤炭作燃料
③用铁矿石炼铁 ④用氨制碳酸铵
(4)目前,关于二氧化碳是否为大气污染物有不同的观点。认为“二氧化碳不是大气污染物”的理由是(填序号)_________。
①二氧化碳是重要的化工原料
②二氧化碳是植物光合作用的必备原料
③二氧化碳是无色、无味、无毒的气体
④除二氧化碳以外,甲烷、一氧化二氮等也是温室气体
(1)下列关于CO2的说法正确的是(填序号)_________。
①减少化石燃料的使用,充分利用太阳能、风能等清洁能源可有效降低大气中CO2的含量
②植树造林,增大植被面积可以有效降低大气中CO2的含量
③二氧化硫、氮氧化物、二氧化碳、悬浮微粒的含量都是空气质量日报的内容
④空气中CO2的含量过高会导致酸雨的形成
(2)下列措施不能减少二氧化碳排放的是(填序号) _________。
①利用太阳能制氢
②关停小火电企业
③举行“地球一小时”熄灯活动
④推广使用煤液化技术
(3)下列反应不产生温室气体的是(填序号)_________。
①用纯碱制玻璃 ②用煤炭作燃料
③用铁矿石炼铁 ④用氨制碳酸铵
(4)目前,关于二氧化碳是否为大气污染物有不同的观点。认为“二氧化碳不是大气污染物”的理由是(填序号)_________。
①二氧化碳是重要的化工原料
②二氧化碳是植物光合作用的必备原料
③二氧化碳是无色、无味、无毒的气体
④除二氧化碳以外,甲烷、一氧化二氮等也是温室气体
工业上用硫铁矿为主要原料抽取硫酸,主要设备有沸腾米,接触室和吸引塔。
(1)硫铁矿在进入沸腾炉前需要粉碎,其目的是 。
(2)为了充分利用反应放出的热量,接触室中应安装 (填设备名称);吸引塔中填充许多瓷管,其作用是 。
(3)吸收塔排放的尾气中含有少量的SO ,防止污染大气、充分利用原料,在排放前必须进行尾气处理并设法进行综合利用。
,防止污染大气、充分利用原料,在排放前必须进行尾气处理并设法进行综合利用。
传统的方法是:尾气中的SO 通常用足量氨水吸收,然后再用稀硫酸处理,写出上述过程中的化学反应方程式:
,其优点是
。
通常用足量氨水吸收,然后再用稀硫酸处理,写出上述过程中的化学反应方程式:
,其优点是
。
创新方法是:将尾气中的SO 用Na
用Na SO
SO 溶液吸收,然后再加热所得溶液,写出上述过程中的化学反应方程式:
,创新方法与传统方法相比,其优点是 。
溶液吸收,然后再加热所得溶液,写出上述过程中的化学反应方程式:
,创新方法与传统方法相比,其优点是 。
(4)在硫酸的工业制法中,下列生产操作及说法生产操作的主要原因二者都正确的是 (填序号)
A.从沸腾炉出来的炉气需净化,因为炉气中的SO 与杂质反应
与杂质反应
B.硫酸生产中常采用高压条件,目的是提高SO 的转化率
的转化率
C.SO 被氧化为SO
被氧化为SO 时需要使用催化剂,这样可以提高SO
时需要使用催化剂,这样可以提高SO 的转化率
的转化率
D.SO 用98.3%浓硫酸吸收,目的是防止形成酸雾,有利于SO
用98.3%浓硫酸吸收,目的是防止形成酸雾,有利于SO 吸收完全
吸收完全
(5)某硫酸厂若要生产8吨98%的浓硫酸至少需要标准状况下的空气
m ( O
( O 空气中的体积分数按20%计算)。
空气中的体积分数按20%计算)。
查看习题详情和答案>>