20. (13分)
氨是氮循环过程中的重要物质,氨的合成是目前普遍使用的人工固氮方法。
 (1)已知:H-H键能为436 kJ/mol,N N键能为945 kJ/mol,N-H键能为391 kJ/mol。写出工业合成氨反应的化学方程式
;由键能计算说明此反应是 反应(填“吸热”或“放热”),合成氨反应(消耗1molN2 时)的△H =
。
(1)已知:H-H键能为436 kJ/mol,N N键能为945 kJ/mol,N-H键能为391 kJ/mol。写出工业合成氨反应的化学方程式
;由键能计算说明此反应是 反应(填“吸热”或“放热”),合成氨反应(消耗1molN2 时)的△H =
。
(2)恒温下,向一个2L的密闭容器中充入1 mol N2和2.6 mol H2,反应过程中对NH3的浓度进行检测,得到的数据如下表所示:
|
时间/min |
5 |
10 |
15 |
20 |
25 |
30 |
|
c(NH3)/(mol/L) |
0.08 |
0.14 |
0.18 |
0.20 |
0.20 |
0.20 |
5min内,用N2浓度的变化表示的反应速率为 ,此条件下该反应的化学平衡常数K= ;反应达到平衡后,保持温度、容积不变,若向平衡体系中加入0.4 mol N2 、 1 mol H2和0.2 mol NH3 ,化学平衡将
向 方向移动(填“正反应”或“逆反应”)。
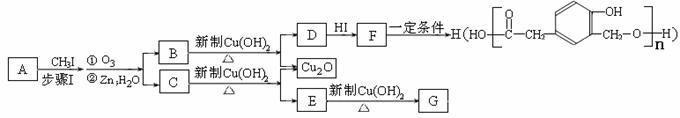
(3)氨是氮肥工业的重要原料。某化肥厂生产铵态氮肥(NH4)2SO4的工艺流程如下:
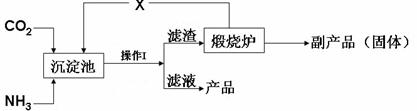
① 向沉淀池中加入CaSO4悬浊液后,需先通入足量NH3,再通入CO2的原因是 。操作Ⅰ的名称是 。
② 煅烧炉中产生的固态副产品为 ,生产流程中能被循环利用的物质X为 。
19. (14分)
A-F六种元素中,除C外其他均为短周期元素,它们的原子结构或性质如下表所示:
|
元素 |
结构或性质 |
|
A |
原子最外层电子数是内层电子总数的1/5 |
|
B |
形成化合物种类最多的元素,其单质为固体 |
|
C |
生活中常见的金属,它有两种常见的氯化物,且相对分子质量相差35.5 |
|
D |
地壳中含量最多的元素 |
|
E |
与D同主族 |
|
F |
与E同周期,且最外层电子数等于电子层数 |
请回答下列问题:
(1)A在元素周期表中的位置是 ;A与E形成的化合物的电子式是 。
(2)C的某种氯化物的浓溶液可以腐蚀印刷电路板上的金属铜,此反应的离子方程式是 。
(3)B的单质与D的氢化物在一定条件下反应生成BD和另一产物的化学方程式是 。
(4)F的盐酸盐水溶液呈酸性,原因是 (用离子方程式表示);F的单质与C、D形成的相对分子质量为160的化合物在一定条件下反应的化学方程式是 。
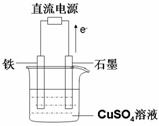
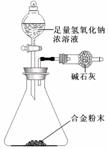 (5)A与F形成的合金是重要的工业材料。某同学仅使用天平和右图所示的装置,粗略
(5)A与F形成的合金是重要的工业材料。某同学仅使用天平和右图所示的装置,粗略
测定某些数据即可求出该合金中A元素的含量。(装置中因空气质量引起的误差忽略不计)
①实验需要测定三个物理量:合金的质量m以及a和b。
a是 ;
b是 。
②合金中A元素的质量分数是 (用含m、a、b的式子表示)。
12. 根据下列实验内容得出的结论正确的是
|
选项 |
实验内容 |
结论 |
|
A |
某物质的水溶液能使红色石蕊试纸变蓝 |
该物质一定是氨气 |
|
B |
某气体能使湿润的淀粉碘化钾试纸变蓝 |
该气体一定是氯气 |
|
C |
某物质的水溶液中加入盐酸产生无色无气味气体 |
该溶液一定含有大量碳酸根离子 |
|
D |
向铁和稀硝酸反应后的溶液中滴加KSCN溶液,溶液显红色 |
反应后溶液中肯定有Fe3+,可能还有Fe2+ |
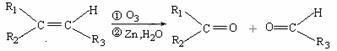 (R1、R2、R3代表烃基)
(R1、R2、R3代表烃基)
 c. O2 + 2H2O + 4 e-
=== 4OH-
c. O2 + 2H2O + 4 e-
=== 4OH- 
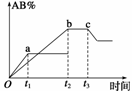 反应A2+B2
反应A2+B2 2AB,在温度或压强改变时,AB%的变化如图所示。a为500℃、b为300℃时的情况;
2AB,在温度或压强改变时,AB%的变化如图所示。a为500℃、b为300℃时的情况; CeI4
+ 2H2↑
CeI4
+ 2H2↑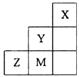 右图为元素周期表中短周期的一部分,关于推断Y、Z、M的说法正确的是
右图为元素周期表中短周期的一部分,关于推断Y、Z、M的说法正确的是