14.(10分)
碘酸钾是一种白色结晶粉末,无臭无味,酸性条件下碘酸钾是一种较强的氧化剂,与氢碘酸、二氧化硫等还原性物质作用,被还原为单质碘,在碱性介质中,碘酸钾能被氯气、次氯酸盐等氧化为高碘酸钾。碘酸钾在常温下稳定;加热至560℃开始分解。工业生产碘酸钾的流程如下,在反应器中发生反应的化学方程式为:
 (未配平)
(未配平)
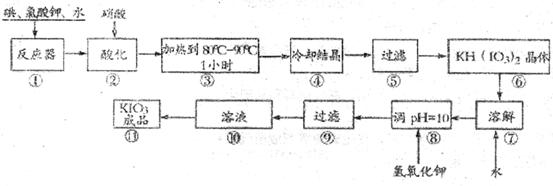
(1)已知步骤①反应器发生的反应中,两种还原产物所得电子数相同,请配平该反应的化学方程式: ;
(2)步骤②中.用稀酸酸化的作用是 ;
在稀硝酸和稀盐酸中不能选用的酸是: ,其原因是
(3)步骤③要保持溶液微沸1小时以完全排出氯气,排出氯气的原因为
(4)参照下表碘酸钾的溶解度,步骤11得到碘酸钾晶体,你建议的方法是 .
|
温度/℃ |
0 |
10 |
20 |
40 |
60 |
80 |
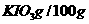 水 水 |
4.60 |
6.27 |
8.08 |
12.6 |
18.3 |
24.8 |
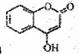 是一种医药中间体,常用来制备抗凝血药,可通过下列路线合成:
是一种医药中间体,常用来制备抗凝血药,可通过下列路线合成: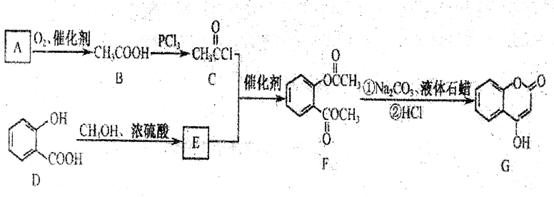
 )用合成路线流程图表示,并注明反应条件)。提示:
)用合成路线流程图表示,并注明反应条件)。提示: 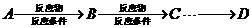
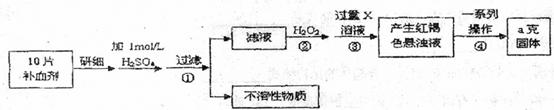
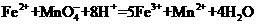 )
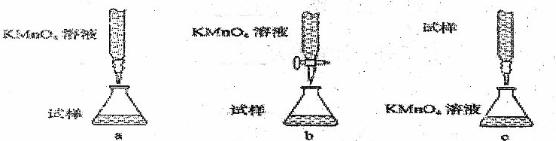
)

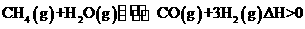 在其它条件不变的情况下降低温度,逆反应速率将
(填“增大”、“减小”或“不变”)。将1.0mLCH4和2.0molH2O通入反应室1(假设容积为100L,10min末有0.lmolCO生成,则10min内反应的平均速率
在其它条件不变的情况下降低温度,逆反应速率将
(填“增大”、“减小”或“不变”)。将1.0mLCH4和2.0molH2O通入反应室1(假设容积为100L,10min末有0.lmolCO生成,则10min内反应的平均速率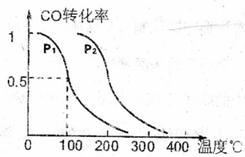 (3)在压强为0.1MPa条件下.反应室3(容积为VL)amolCO与2amolH2在催化剂作用下反应生成甲醇:
(3)在压强为0.1MPa条件下.反应室3(容积为VL)amolCO与2amolH2在催化剂作用下反应生成甲醇: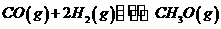 ,CO的平衡转化率与温度、压强的关系如右图所示,则:
,CO的平衡转化率与温度、压强的关系如右图所示,则: =0,(填“<”
、“>”或“=”).
=0,(填“<”
、“>”或“=”).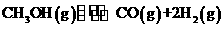 ,反应的平衡常数为
(用含a、V的代数式表示)。
,反应的平衡常数为
(用含a、V的代数式表示)。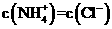 。则溶液显
性(填“酸”“碱”或“中”);用含a的代数式表示NH3·H2O的电离常数Kb=
。
。则溶液显
性(填“酸”“碱”或“中”);用含a的代数式表示NH3·H2O的电离常数Kb=
。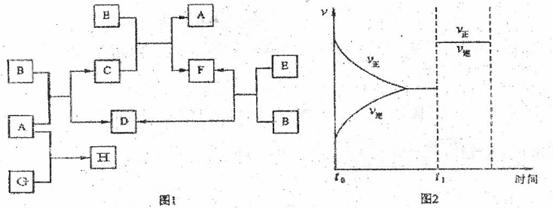
 F(g)+D(g)反应速率和时间的关系如图2所示,那么在t1时速率发生改变的原因可能是(填选项字母)
。
F(g)+D(g)反应速率和时间的关系如图2所示,那么在t1时速率发生改变的原因可能是(填选项字母)
。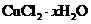 )。有如下操作:
)。有如下操作:
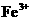 几乎完全水解而沉淀,而此时
几乎完全水解而沉淀,而此时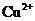 却几乎不水解。
却几乎不水解。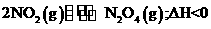 。现将一定量NO2
。现将一定量NO2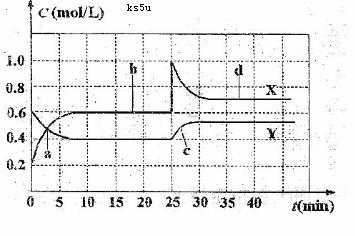
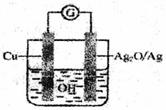 普通水泥在固化过程中自由水分子减少并形成碱性溶液。根据这一物理化学特点,科学家发明了电动势法测水泥的初凝时间。此法的原理如图所示,反应的总方程式为:2Cu+Ag2O=Cu2O十2Ag下列有关说法正确的是
普通水泥在固化过程中自由水分子减少并形成碱性溶液。根据这一物理化学特点,科学家发明了电动势法测水泥的初凝时间。此法的原理如图所示,反应的总方程式为:2Cu+Ag2O=Cu2O十2Ag下列有关说法正确的是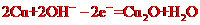
 向正极移动
向正极移动