19. (16分,每空2分)某校化学实验兴趣小组在“探究卤素单质的氧化性”的系列实验中发现:在足量的稀氯化亚铁溶液中,加入1-2滴溴水,振荡后溶液呈黄色。
(1)提出问题:Fe3+、Br2谁的氧化性更强?
(2)猜想:
①甲同学认为氧化性:Fe3+>Br2,故上述实验现象不是发生化学反应所致,则溶液呈黄色是含_________(填化学式,下同)所致。
②乙同学认为氧化性:Br2>Fe3+,故上述实验现象是发生化学反应所致,则溶液呈黄色是含 ________所致。
(3)设计实验并验证:丙同学为验证乙同学的观点,选用下列某些试剂设计出两种方案进行实验,并通过观察实验现象,证明了乙同学的观点确实是正确的。
供选用的试剂:a. 酚酞试液 b. 四氯化碳 c. 无水酒精 d. 硫氰化钾溶液
请你在下列表格中写出丙同学选用的试剂及实验中观察到的现象。(试剂填序号)
|
|
选用试剂 |
实验现象 |
|
方案1 |
|
|
|
方案2 |
|
|
(4)应用与拓展:
①在100mL2 mol·L-1FeBr2溶液中通入4.48LCl2(标准状况),溶液呈黄色所发生的离子方程式为 。
②在100mLFeBr2溶液中通入2.24LCl2(标准状况),溶液中有1/3的Br-被氧化成单质Br2,则原FeBr2溶液中FeBr2的物质的量浓度为 。
17.(14分,每空2分)下表由元素周期表的前三周期去掉副族上方空区域后组合而成。请用相应的化学用语回答下列问题。
|
a |
|
|
|||||
|
b |
|
|
c |
d |
e |
f |
|
|
g |
|
h |
|
|
i |
|
|
(1)请写出满足以下要求的2个置换反应的化学方程式。
①所涉及的元素均为a-i中的元素;
② 4种单质分属于4个不同 的主族。
; 。
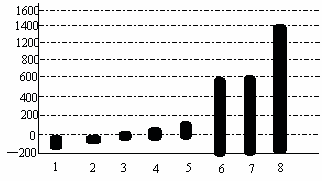
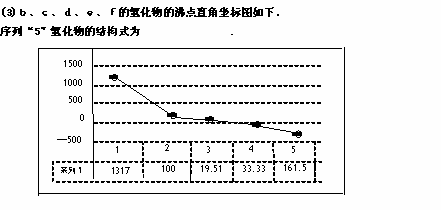
(2)第三周期8种元素按单质熔点(℃)大小顺序的柱形图如下(已知柱形1代表Ar),则其中序列“2”表示的单质为 (填化学式)。
(4)单质a单质e可以设计为新型燃料电池,电解质为KOH溶液,则单质e在该燃料电池
的 极发生电极反应,电极反应式为 。
(5)在e单质中燃料4克i单质生成一种有刺激性气味的气体,同时放出aKJ热量,写出该反应的热化学方程式 。
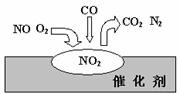 在汽车尾气净化装置里,气体在催化剂表面吸附与解吸作用的过程如图,下列说法错误的是
在汽车尾气净化装置里,气体在催化剂表面吸附与解吸作用的过程如图,下列说法错误的是 4CO2+N2
4CO2+N2 、NO
、NO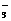
 (2)D的电子式为
;
(2)D的电子式为
;