0 41283 41291 41297 41301 41307 41309 41313 41319 41321 41327 41333 41337 41339 41343 41349 41351 41357 41361 41363 41367 41369 41373 41375 41377 41378 41379 41381 41382 41383 41385 41387 41391 41393 41397 41399 41403 41409 41411 41417 41421 41423 41427 41433 41439 41441 41447 41451 41453 41459 41463 41469 41477 447348
 下列实验能证明某无色气体为SO2的是
( )
下列实验能证明某无色气体为SO2的是
( )
 K2MnO4+MnO2+O2↑
K2MnO4+MnO2+O2↑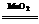 2H2O+O2↑
2H2O+O2↑ 答案:(1)2.6g(2)1.335g(3)130mL
答案:(1)2.6g(2)1.335g(3)130mL
 MgCl2+2NaOH===Mg(OH)2↓+2NaCl
0.02mol
MgCl2+2NaOH===Mg(OH)2↓+2NaCl
0.02mol 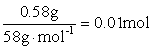 NaOH + HCl == NaCl + H2O
0.005mol 0.01L×0.5mol/L
AlO2- + H+ + H2O == Al(OH)3↓
0.01mol 0.02L×0.5mol/L 0.01mol
AlCl3 + 4NaOH == NaAlO2 + 3NaCl
0.01mol 0.04mol 0.01mol
由上述可知,n(NaOH)=0.02mol+0.005mol+0.04mol=0.065mol
所以m(NaOH)=0.065mol×40g/mol=2.6g
(2)由(1)可知,n(AlCl3)=0.01mol 所以m(AlCl3)=0.01mol×133.5g/mol=1.335g
(3)由图知:P点溶液的溶质为NaCl、AlCl3、MgCl2,相当于用盐酸中和了原溶液中的NaOH所得的结果,所以n(HCl)=n(NaOH)=0.065mol,
NaOH + HCl == NaCl + H2O
0.005mol 0.01L×0.5mol/L
AlO2- + H+ + H2O == Al(OH)3↓
0.01mol 0.02L×0.5mol/L 0.01mol
AlCl3 + 4NaOH == NaAlO2 + 3NaCl
0.01mol 0.04mol 0.01mol
由上述可知,n(NaOH)=0.02mol+0.005mol+0.04mol=0.065mol
所以m(NaOH)=0.065mol×40g/mol=2.6g
(2)由(1)可知,n(AlCl3)=0.01mol 所以m(AlCl3)=0.01mol×133.5g/mol=1.335g
(3)由图知:P点溶液的溶质为NaCl、AlCl3、MgCl2,相当于用盐酸中和了原溶液中的NaOH所得的结果,所以n(HCl)=n(NaOH)=0.065mol, 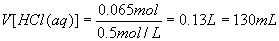
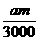 (2)a≥4b (3)3b<a<4b (4mb-ma)×10-3 mol
(2)a≥4b (3)3b<a<4b (4mb-ma)×10-3 mol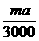 mol
mol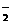 +2H2O
+2H2O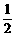 ≤a<1。
≤a<1。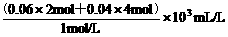 =440 mL。
=440 mL。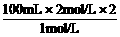 =400 mL。
=400 mL。