18.(共11分)(1)已知在25℃时,醋酸、碳酸和亚硫酸的电离平衡常数分别为:
醋酸 Ki = 1.75×10-5
碳酸 Ki 1= 4.30×10-7 Ki 2 = 5.61×10-11
亚硫酸 Ki 1= 1.54×10-2 Ki 2 = 1.02×10-7
① 写出碳酸的第一级电离平衡常数表达式:Ki = _________________
② 在相同条件下,试比较H2CO3、HCO3-和HSO3-的酸性强弱:_____>_____>_____
③ 若保持温度不变,在醋酸溶液中加入少量盐酸,下列量会变小的是______(填序号)
A. c(CH3COO-) B. c(H+) C.醋酸电离平衡常数 D. 醋酸的电离度
(2)一定温度下的难溶电解质AmBn在水溶液中达到沉淀溶解平衡时,其平衡常数
Ksp=cm(An+)×cn(Bm-),称为难溶电解质的离子积。在25℃时,AgCl的白色悬浊液中,依次加入等浓度的KI溶液和Na2S溶液,观察到的现象是先出现黄色沉淀,最后生成黑色沉淀。已知有关物质的颜色和溶度积如下:
|
物质 |
AgCl |
AgI |
Ag2S |
|
颜色 |
白 |
黄 |
黑 |
|
KSP(25℃) |
1.8×10-10 |
1.5×10-16 |
1.8×10-50 |
下列叙述不正确的是
A.溶度积小的沉淀可以转化为溶度积更小的沉淀
B.若先加入Na2S溶液,再加入KCl溶液,则无白色沉淀产生
C.25℃时,饱和AgCl、AgI、Ag2S溶液中所含Ag+的浓度相同
D.25℃时,AgCl固体在等物质的量浓度的NaCl、CaCl2溶液中的溶度积相同
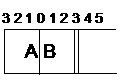 (8分)如图所示,温度不变下某容器分隔成A、B两部分,A容器固定不变,B有可移动的活塞,现在A中充入2molSO2和1molO2,在B中充入2 molSO3和1molN2,在相同条件下发生可逆反应:
(8分)如图所示,温度不变下某容器分隔成A、B两部分,A容器固定不变,B有可移动的活塞,现在A中充入2molSO2和1molO2,在B中充入2 molSO3和1molN2,在相同条件下发生可逆反应: 2SO3(g),根据下列要求填空:
2SO3(g),根据下列要求填空: 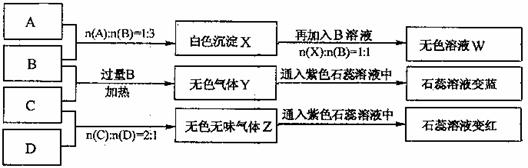
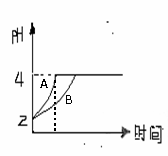 (2)常温下,取pH=2的盐酸和醋酸溶液各100mL,向其中分别加入适量的Zn粒,反应过程中两溶液的pH变化如右图所示。则图中表示醋酸溶液中pH变化
(2)常温下,取pH=2的盐酸和醋酸溶液各100mL,向其中分别加入适量的Zn粒,反应过程中两溶液的pH变化如右图所示。则图中表示醋酸溶液中pH变化 A.混合液的pH=7 B.a=b
A.混合液的pH=7 B.a=b 
 D.溶液乙中, c(HX)>c(Na+)>c(X-)>c(OH-)> c(H+)
D.溶液乙中, c(HX)>c(Na+)>c(X-)>c(OH-)> c(H+)