0 41295 41303 41309 41313 41319 41321 41325 41331 41333 41339 41345 41349 41351 41355 41361 41363 41369 41373 41375 41379 41381 41385 41387 41389 41390 41391 41393 41394 41395 41397 41399 41403 41405 41409 41411 41415 41421 41423 41429 41433 41435 41439 41445 41451 41453 41459 41463 41465 41471 41475 41481 41489 447348
 、CO32-、NH4+、M,且SO42-、CO32-、NH4+离子的物质的量之比为1∶2∶4,则离子M可能是
、CO32-、NH4+、M,且SO42-、CO32-、NH4+离子的物质的量之比为1∶2∶4,则离子M可能是 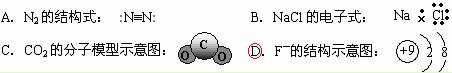
 Ag2O+Zn+H2O
Ag2O+Zn+H2O
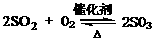



 2SO3。
2SO3。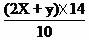 ×100%=(0.04+0.064) ×14/10×100%=14.56%
×100%=(0.04+0.064) ×14/10×100%=14.56% Fe(OH)2 + 2H+的平衡向逆反应方向移动,从而抑制FeSO4的水解
Fe(OH)2 + 2H+的平衡向逆反应方向移动,从而抑制FeSO4的水解