0 41445 41453 41459 41463 41469 41471 41475 41481 41483 41489 41495 41499 41501 41505 41511 41513 41519 41523 41525 41529 41531 41535 41537 41539 41540 41541 41543 41544 41545 41547 41549 41553 41555 41559 41561 41565 41571 41573 41579 41583 41585 41589 41595 41601 41603 41609 41613 41615 41621 41625 41631 41639 447348
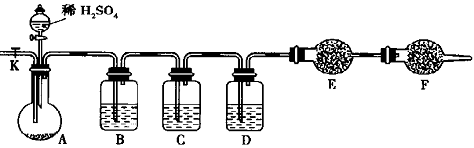
 (1)下列有关实验的叙述中,正确的是
。
(1)下列有关实验的叙述中,正确的是
。
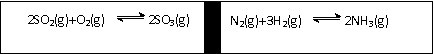
 A.①② B.③ C.③④
D.④
A.①② B.③ C.③④
D.④ bY(g) + cZ(g),达到平衡后,保持温度不变,将容器的容积压缩为原来容积的一半,当达到新平衡时,物质Y和Z的浓度均是原来的1.8倍。则下列叙述不正确的是
( )
bY(g) + cZ(g),达到平衡后,保持温度不变,将容器的容积压缩为原来容积的一半,当达到新平衡时,物质Y和Z的浓度均是原来的1.8倍。则下列叙述不正确的是
( ) 已知反应2SO2(g)+O2(g)
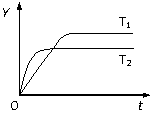
已知反应2SO2(g)+O2(g)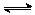 2SO3(g);ΔH<0,向某体积恒定的密闭容器中按体积比2∶1充入SO2和O2,在一定条件下发生反应。下图是某物理量(Y)随时间(t)变化的示意图(图中T表示温度),Y可以是( )
2SO3(g);ΔH<0,向某体积恒定的密闭容器中按体积比2∶1充入SO2和O2,在一定条件下发生反应。下图是某物理量(Y)随时间(t)变化的示意图(图中T表示温度),Y可以是( )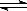 2E(g),若开始时只有充入2
mol E(g),达平衡时,E的转化率为40%;若开始时充入2
mol M和1
mol N的混合气体,达平衡时混合气体的压强比起开始时减少了( )
2E(g),若开始时只有充入2
mol E(g),达平衡时,E的转化率为40%;若开始时充入2
mol M和1
mol N的混合气体,达平衡时混合气体的压强比起开始时减少了( )