0 41244 41252 41258 41262 41268 41270 41274 41280 41282 41288 41294 41298 41300 41304 41310 41312 41318 41322 41324 41328 41330 41334 41336 41338 41339 41340 41342 41343 41344 41346 41348 41352 41354 41358 41360 41364 41370 41372 41378 41382 41384 41388 41394 41400 41402 41408 41412 41414 41420 41424 41430 41438 447348
 2NH3(g),若在恒温、恒压条件下向平衡体系中通入氩气,则平衡
2NH3(g),若在恒温、恒压条件下向平衡体系中通入氩气,则平衡 与0.01 mol·L-1的盐酸等体积混合,反应平衡时溶液中
与0.01 mol·L-1的盐酸等体积混合,反应平衡时溶液中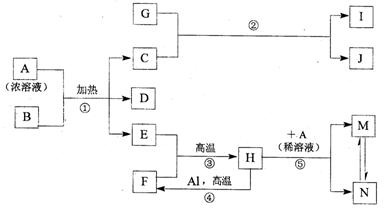
 2Z(g);△H<0,下图表示该反应的速率(v)随时间(t)变化的关系,t1、t3、t4时刻外界条件有所改变,但都没有改变各物质的初始加入量。下列说法中不正确的是
2Z(g);△H<0,下图表示该反应的速率(v)随时间(t)变化的关系,t1、t3、t4时刻外界条件有所改变,但都没有改变各物质的初始加入量。下列说法中不正确的是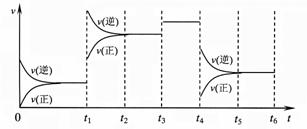
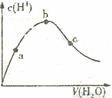
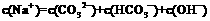
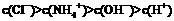
 2SO3(g);△H=-196.6kJ/mol
2SO3(g);△H=-196.6kJ/mol