16.(18分)芳香族化合物在生产生活中有广泛的用途。
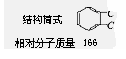 Ⅰ。实验室一试剂瓶标签严重破损,只能隐约看到一部分:
Ⅰ。实验室一试剂瓶标签严重破损,只能隐约看到一部分:
取该试剂瓶中的试剂,通过燃烧实验测得:16.6g 该物
质完全燃烧得到39.6g CO2 与9g H2O。
(1)通过计算可知该有机物的分子式为: 。
(2)进一步实验可知:①该物质能与碳酸氢钠溶液反应生成无色无味气体。②16.6g 该物质与足量NaOH反应,消耗0.1mol NaOH。请写出一种符合该物质结构的结构简式:
|
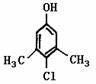
Ⅱ。滴露是一种常用消毒剂。它的主要成分结构如图1:
(1)它具有的官能团的名称:
(2)该分子在核磁共振氢谱图中显示出 种峰,
其峰面积比为
 (3)写出它与氢氧化钠溶液反应的化学方程式
(3)写出它与氢氧化钠溶液反应的化学方程式
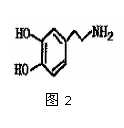
 Ⅲ。多巴胺是在大脑的相应部位传递快乐信息化学物质,结构如图2:
Ⅲ。多巴胺是在大脑的相应部位传递快乐信息化学物质,结构如图2:
(1)多巴胺可由香兰素与硝基甲烷缩合,再经锌还原水解而得。合成过
程示如下:
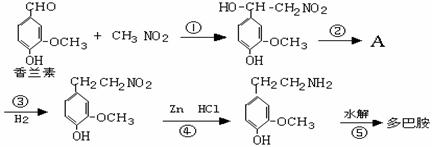
写出上述过程中①的反应类型:
写出②、⑤两步的化学方程式:
②:
⑤:
(2)写出香兰素的银镜反应的化学方程式
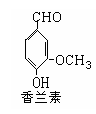 (3)写出符合下列条件的香兰素的所有同分异构体的结构简式:①苯环上有两个取代基,其苯环上的一溴代物有两种;②能发生水解反应;
③显弱酸性
(3)写出符合下列条件的香兰素的所有同分异构体的结构简式:①苯环上有两个取代基,其苯环上的一溴代物有两种;②能发生水解反应;
③显弱酸性
15.(13分)下表列出了部分常见含有10电子和18电子的粒子,回答下列问题。
|
10电子粒子 |
CH4、NH3、H2O、HF、Na+、Al3+、NH4
+、OH- |
|
18电子粒子 |
H2S、HCl、K+ 、Cl- 、C2H6 …… |
(1)表中-1价的简单离子在周期表中的位置是 (周期、族)。其单质有毒,常用强碱溶液吸收,反应的离子方程式为
(2)表中水溶液显碱性的分子的电子式是
写出其催化氧化的化学方程式
(3)写出由表中两种10电子粒子相互反应,生成两种10电子粒子的离子方程式
。
(4)表中在水溶液中能够促进水电离的粒子有
(5)由表中离子组成的NaOH是常用的试剂,下图是配置一定物质的量浓度的氢氧化钠溶液的操作图示,整个过程分为①②③④⑤⑥六个单元。
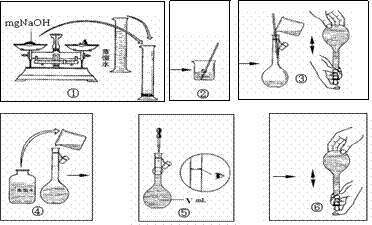
其中操作有错误的单元有(选填①②……)
(6)由第二周期元素形成的氢化物A和B都含有18电子, A是一种6原子分子,可做火箭发动机的燃料,B是一种常见强氧化剂。已知16g液态A与液态B充分反应生成一种液态10电子分子和一种气态单质,并放出838 kJ热量。写出A与B反应的热化学方程式
12.几种短周期元素部分性质的数据见下表:
|
元素性质 |
元素编号 |
|
① ② ③ ④ ⑤ ⑥ ⑦ |
|
|
原子半径 |
0.74 1.60 1.52 1.10 0.99 1.86 0.75 |
|
最高正化合价 |
无 +2 +1 +5 +7 +1 +5 |
|
最低负化合价 |
-2 无 无 -3 -1 无
-3 |
下列说法正确的是 ( )
A.③、⑥号元素都是金属元素
B.⑤的单质(M)与水反应的化学方程式为:2M + 2H2O= 2MOH + H2↑
C.⑥是该周期元素中原子半径最小的元素
D.①、⑥号元素只能形成一种白色化合物
 食物的选择与其酸碱性关系很大。下列食物中,属于酸性食物的是
食物的选择与其酸碱性关系很大。下列食物中,属于酸性食物的是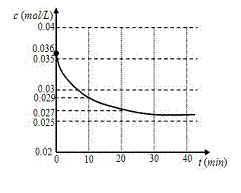 CO(g) + H2O(g)
CO(g) + H2O(g)  CO2(g) + H2(g)
在密闭容器中,将1.0 mol CO与1.0mol H2O混合
CO2(g) + H2(g)
在密闭容器中,将1.0 mol CO与1.0mol H2O混合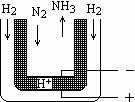 (13分)氨是最重要的氮肥原料。在课本里学到的合成氨技术
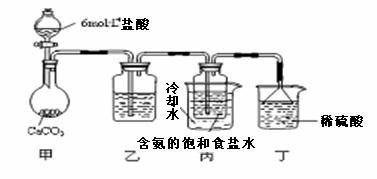
(13分)氨是最重要的氮肥原料。在课本里学到的合成氨技术 NH4HCO3+NaCl
NH4HCO3+NaCl

 下列混合溶液中,各离子浓度的大小顺序正确的是
( )
下列混合溶液中,各离子浓度的大小顺序正确的是
( )