33.(15分)请你设计实验探究促进或抑制FeCl3水解的条件,了解影响盐类水解程度的因素。
仅限选择的仪器、用品和试剂:烧杯、试管、玻璃棒、胶头滴管、量筒、酒精灯、pH计、pH试纸;lmol/L盐酸、氯化氢气体、1mol/L氢氧化钠、lmol/L氯化铁、蒸馏水。
完成下列探究过程:
(1)写出FeCl3水解的离子方程式:
(2)针对FeCl3水解的影响因素提出假设:
假设 l :溶液的酸碱性 ;
假设 2: ;
假设 3 : 。
(3)基于以上3个假设 , 设计出实验方案,将实验操作、预期的实验现象和结论填在下表中。
|
步骤编号 |
实验操作 |
预期现象和结论 |
|
① |
|
|
|
② |
|
|
|
③ |
|
|
|
|
|
|
|
…… |
…… |
…… |
31.(18分)工业合成氨与制备硝酸一般可连续生产,流程如下:
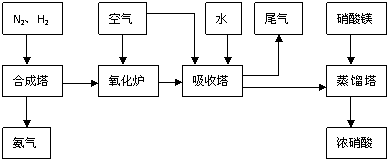

(1)工业生产时,制取氢气的一个反应为:CO+H2O CO2+H2
CO2+H2
①t℃时,往1L密闭容器中充入0.2mol CO和0.3mol水蒸气。反应建立平衡后,体系中c(H2)=0.12mol·L-1。该温度下此反应的平衡常数K= 。
②保持温度不变,向上述平衡体系中再加入0.1molCO,当反应重新建立平衡时,水蒸气的总转化率α (H2O)= 。
(2)合成塔中发生反应为:N2(g)+3H2(g)
 2NH3(g);△H<0。右表为不同温度下该反应的平衡常数。由此可推知,表中T1 573K(填“>”、“<”或“=”)。
2NH3(g);△H<0。右表为不同温度下该反应的平衡常数。由此可推知,表中T1 573K(填“>”、“<”或“=”)。
|
T/K |
T1 |
573 |
T2 |
|
K |
1.00×107 |
2.45×105 |
1.88×103 |
 (3)NH3和O2在铂系催化剂作用下从145℃就开始反应:
(3)NH3和O2在铂系催化剂作用下从145℃就开始反应:
4NH3+5O2 4NO+6H2O △H=-905kJ·mol-1
4NO+6H2O △H=-905kJ·mol-1
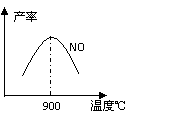
不同温度下NO产率如图所示。温度高于900℃时,NO产率下降的原因 。
(4)吸收塔中反应为:3NO2+H2O 2HNO3+NO。从生产流程看,吸收塔中需要补充空气,其原因是
。
2HNO3+NO。从生产流程看,吸收塔中需要补充空气,其原因是
。
(5)硝酸厂的尾气含有氮氧化物,不经处理直接排放将污染空气。目前科学家探索利用燃料气体中的甲烷等将氮氧化物还原为氮气和水,其反应机理为:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g); △H=-574kJ·mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g); △H=-1160kJ·mol-1
则甲烷直接将NO2还原为N2的热化学方程式为:________________________________。
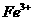
 ③KIO3能将I-氧化为I2,也能将Br-氧化为Br2,本身被还原为I2。
③KIO3能将I-氧化为I2,也能将Br-氧化为Br2,本身被还原为I2。

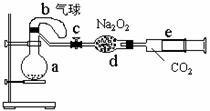 (3)化学研究性学习小组的其它同学对上述实验进行了研究,认为装置Ⅱ只能定性研究铜与硝酸的反应,他们又重新设计了一套实验,装置图如右:a中盛有标况下的空气(氧气占五分之一)和10mL,1.2mol/L硝酸的250mL烧瓶。b是未充气(实验开始前内部没有气体)放有0.384g铜粉的气球。(整套装置已经过气密性检查合格。)他们做了以下实验,请填写有关空白:
①将气球中的铜粉小心倒入烧瓶中,充分反应后发现 铜粉有余(设产生的气体不溶解于溶液中),则可观察到的是
②将烧瓶不断振荡发现气球逐渐缩小,发生有关反应的化学方程式是:
;
(3)化学研究性学习小组的其它同学对上述实验进行了研究,认为装置Ⅱ只能定性研究铜与硝酸的反应,他们又重新设计了一套实验,装置图如右:a中盛有标况下的空气(氧气占五分之一)和10mL,1.2mol/L硝酸的250mL烧瓶。b是未充气(实验开始前内部没有气体)放有0.384g铜粉的气球。(整套装置已经过气密性检查合格。)他们做了以下实验,请填写有关空白:
①将气球中的铜粉小心倒入烧瓶中,充分反应后发现 铜粉有余(设产生的气体不溶解于溶液中),则可观察到的是
②将烧瓶不断振荡发现气球逐渐缩小,发生有关反应的化学方程式是:
;