2.
|
实验方法 |
实验过程中所发生
反应的化学方程式 |
实验所用仪器 (用编号表示) |
实验需直接测定的有关物理量 (用文字说明) |
|
1 |
H2SO4+Zn=ZnSO4+H2↑ H2+CuO 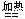 Cu+H2O Cu+H2O |
①②③⑦ |
实验前样品和硬质玻璃管的总质量(或硬质玻璃管的质量) 实验后Cu及硬质玻璃管的总质量 |
|
2 |
H2SO4+CuO=CuSO4+H2O |
①⑤⑧⑨ |
过滤后剩余固体的质量 |
|
3 |
2Cu+O2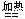 2CuO 2CuO |
①④⑥⑦⑧ |
实验前坩埚与样品总质量 (或坩埚质量) 实验后坩埚与CuO总质量 |
(以上三种方法任选两种,其它合理的方法也可以)
5.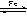 1,2,3,4-四氢化萘的结构简式是
,分子式是C10H12。常温下为无色液体,有刺激性气味,沸点207℃,不溶于水,是一种优良的溶剂,它与液溴发生反应:C10H12+4Br2 C10H8Br4+4HBr。生成的四溴化萘常温下为固态,不溶于水。有人用四氢化萘、液溴、蒸馏水和纯铁粉为原料,制备少量饱和氢溴酸溶液,实验步骤如下:①按一定质量比把四氢化萘和水加入适当的容器中,加入少量纯铁粉。②慢慢滴入液溴,不断搅拌,直到反应完全。③取下反应容器,补充少量四氢化萘,直到溶液颜色消失。过滤,将滤液倒入分液漏斗,静置。④分液,得到的“水层”即氢溴酸溶液。
1,2,3,4-四氢化萘的结构简式是
,分子式是C10H12。常温下为无色液体,有刺激性气味,沸点207℃,不溶于水,是一种优良的溶剂,它与液溴发生反应:C10H12+4Br2 C10H8Br4+4HBr。生成的四溴化萘常温下为固态,不溶于水。有人用四氢化萘、液溴、蒸馏水和纯铁粉为原料,制备少量饱和氢溴酸溶液,实验步骤如下:①按一定质量比把四氢化萘和水加入适当的容器中,加入少量纯铁粉。②慢慢滴入液溴,不断搅拌,直到反应完全。③取下反应容器,补充少量四氢化萘,直到溶液颜色消失。过滤,将滤液倒入分液漏斗,静置。④分液,得到的“水层”即氢溴酸溶液。
 回答下面问题:
回答下面问题:
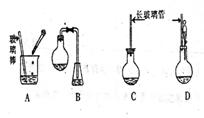
(1)下面示意图中的装置,适合步骤①和②操作的是 ;
(2)步骤②中如何判断“反应完全” ;
(3)步骤③中补充少量四氢化萘的目的是 ;
(4)步骤③中过滤后得到的固体物质是 ;
(5)已知在实验条件下,饱各氢溴酸水溶液中氢溴酸的质量分数是66%,如果溴化反应进行完全,则步骤①中四氢化萘和水的质量比约是1: (保留小数点后1位)。
|
Cu2(OH)2CO3·xH2O 2CuO+CO2↑+(x+1)H2O
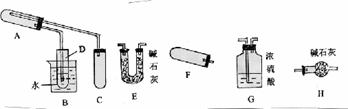 现取一定量该粉末(未精确测定质量)样品,用下图所列仪器(夹持、加热等仪器均略)先后进行两个实验:
现取一定量该粉末(未精确测定质量)样品,用下图所列仪器(夹持、加热等仪器均略)先后进行两个实验:
(Ⅰ)测定该粉末组成中结晶水的x值;
(Ⅱ)用前一个实验结束后的残留固体与乙醇蒸气反应(该残留固体可使乙醇发生去氢氧化),并检验反应产物。(已知乙醇的沸点为78℃)
(1)见图中已装配好一套装置,回答下列问题:
①该装置用于进行实验(选填Ⅰ或Ⅱ) ,需加热的仪器有(选填序号字母) ;
②在试管D中所放试剂及可观察到的现象是 ,
反应的离子方程式为 ;
③为确保反应物有较高的利用率,且使装置中气流平稳,应对C部分进行的改进是 ;
(2)用图中其它仪器组装完成另一实验的装置,回答以下问题:
①这些仪器按气流从左到右方向的连接顺序是(填写序号字母) → → →H;其中H的作用是 ;
②组装试管F时,试管口应略向下倾斜,其原因是 ;
(3)若各装置中的反应都能进行完全,实验后测得A中固体质量减轻ag、E增重bg、G增重cg,则表示结晶水x值的计算式为(从a、b、c中选两个量求算,不必化简) 。
答案分析:
纠错训练
2. 实验室有CuO和Cu粉的混合物。请你利用给出的实验仪器及试剂,设计两种测定该样品(已称得其质量为m克)中氧化铜质量分数的方法,并填写表格中的有关内容。
|
实验 方法 |
实验过程中所发生反应的 化学方程式 |
实验所用仪器 (用编号表示) |
实验需直接测定的有关物理量 (用文字说明) |
|
1 |
|
|
|
|
2 |
|
|
|
实验可能用到的主要仪器:
①托盘天平 ②启普发生器 ⑧硬质玻璃管 ④泥三角 ⑤烧杯 ⑥坩埚 ⑦酒精灯 ⑧玻棒 ⑨漏斗 ⑩干燥管
实验可能用到的试剂:
a.锌粒 b.稀硫酸 c.氯化钠溶液 d,浓硫酸
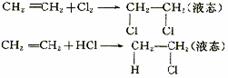 方法1:先在一个气球内充入与烧瓶等体积的Cl2或HCl气体。打开止水夹K,从图中止水夹K处将气体缓缓送入烧瓶内,因为
方法1:先在一个气球内充入与烧瓶等体积的Cl2或HCl气体。打开止水夹K,从图中止水夹K处将气体缓缓送入烧瓶内,因为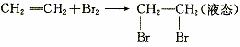
 (1)混合气体进入反应管后,量气管内增加的水的体积等于 的体积(填写气体的分子式)。
(1)混合气体进入反应管后,量气管内增加的水的体积等于 的体积(填写气体的分子式)。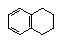 a.烧杯 b.试管 c.广口瓶 d.容量瓶 e.量筒 f.单孔塞 g.双孔塞
a.烧杯 b.试管 c.广口瓶 d.容量瓶 e.量筒 f.单孔塞 g.双孔塞