(二)卤族元素
1、卤素原子结构(1)示意图:F Cl Br I 。
最外层电子数相同,但电子层数逐渐增大,得电子能力 ,非金属性 。
2、卤族元素单质的物理性质的变化规律 (随原子序数的递增)
(1)颜色:__色-__色-___色-__色 (颜色逐渐加深 ) (2)状态: _态-_态-_态(3)熔沸点:逐渐__ (4)密度: 逐渐__ (5)水溶解性:逐渐__。
3、卤素单质与氢气反应
|
名称 |
反应条件 |
方程式 |
生成氢化物的稳定性 |
||||
|
F2 |
_____ |
H2+F2====2HF |
HF很稳定 |
||||
|
Cl2 |
_____ |
|
HCl稳定 |
||||
|
Br2 |
_____ |
H2+Br2======2HBr |
HBr较不稳定 |
||||
|
I2 |
_____ |
H2+I2======2HI |
HI___稳定 |
(4)随核电荷数的增加,卤素单质氧化性逐渐减弱:Cl2+_NaBr-______;氟气与氯化钠水溶液反应:____________。
疑难点拨
(一)碱金属元素
1、原子结构
|
|
元素名称 |
核电荷数 |
原子结构示意图 |
最外层电子数 |
电子层数 |
|
碱 金 属 元 素 |
|
|
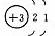 |
|
|
|
|
|
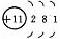 |
|
|
|
|
|
|
 |
|
|
|
|
|
|
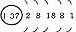 |
|
|
|
|
|
|
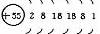 |
|
|
结构异同:异:核电荷数:由_→_;电子层数:由_→_;同:最外层电子数均为_个。单质密度逐渐 ,熔沸点逐渐 。
2、碱金属的化学性质:钾的保存及取用方法: 。
(1)与氧气反应差异性:
Li+O2 _(_色、氧化锂);_Na+O2
_(_色、氧化锂);_Na+O2 __(_色、过氧化钠);_K+O2
__(_色、过氧化钠);_K+O2 _(_色,_氧化钾);_Rb+_O2
_(_色,_氧化钾);_Rb+_O2 _(棕色、_氧化铷);_CS+_O2
_(棕色、_氧化铷);_CS+_O2 _(_色、_氧化铯)。
_(_色、_氧化铯)。
(2)与水反应差异性:(填反应现象)
2Li+2H2O=2LiOH+H2↑(__);2Na+2H2O=2NaOH+H2↑(剧烈);2K+2H2O=2KOH+H2↑(____、__);2Rb+2H2O=2RbOH+H2↑(更猛烈、燃烧、爆炸)。
(3)写出下列反应的化学方程式:
过氧化钾与CO2: ;超氧化钾与水、CO2: 、 ;
氧化锂与水、CO2 : 、 。
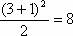 种,第4周期为
种,第4周期为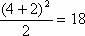 种。 (4) 同主族相邻元素的原子序数:第IA、IIA族,下一周期元素的原子序数=上一周期元素的原子序数+上一周期元素的数目;第IIIA-VIIA族,下一周期元素的原子序数=上一周期元素的原子序数+下一周期元素的数目。
种。 (4) 同主族相邻元素的原子序数:第IA、IIA族,下一周期元素的原子序数=上一周期元素的原子序数+上一周期元素的数目;第IIIA-VIIA族,下一周期元素的原子序数=上一周期元素的原子序数+下一周期元素的数目。