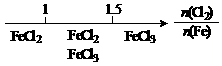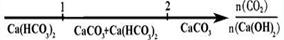23.氧族元素的各种性质可归纳整理出如下(部分):
※(元素周期表中第ⅥA元素又称为氧旅元素)
|
元素 性质 |
8O |
16S |
Se |
52Te |
|
单质沸点(℃) |
-183 |
444.6 |
685 |
1390 |
|
主要化合价 |
-2 |
-2,+4,+6 |
-2,+4,+6 |
|
|
原子半径(nm) |
0.074 |
0.102 |
0.116 |
0.143 |
|
单质与H2反应 |
点热易化合 |
加热化合 |
加热难化合 |
不能直接化合 |
 回答下列问题:
回答下列问题:
|
(2)H2O2可以作脱氯剂,用于消除水中的Cl2,写出该反应的化学方程式: 。
(3)碲的主要化合价可能有 。
(4)工业上可用Al2Te3制备H2Te,化学方程式为: 。
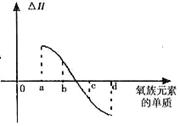
(5)右图所示为上述氧族元素单质与H2反应过程中的能量变化示意图,其中a、b、c、d分
别表示氧族中某一元素的单质,△H为相同物质的量的单质与H2反应过程中的能量变化(反
应的热效应)。则:b代表 ,d代表 (写化学式)。
22.已知a、b、c、d、e分别是Ca(OH)2、Ca(HCO3)2、HCl、Ba(NO3)2、Na2CO3五种物质水溶液中的各一种。它们互相反应的情况如下表所示
|
|
a |
b |
c |
d |
e |
|
c |
↓ |
↓ |
╱ |
↑ |
- |
|
b |
↓ |
╱ |
↓ |
- |
- |
“↓”表示生成沉淀;“↑”表示产生气体;“-”表示无明显现象;“╱”表示实验未做。
 则c 是
e是
(均填化学式)
则c 是
e是
(均填化学式)
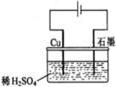 A.电解过程中,铜电极上有H2产生w w w.k s 5 u. co m
A.电解过程中,铜电极上有H2产生w w w.k s 5 u. co m
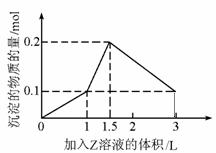 1L某混合溶液中,溶质X、Y的浓度都为0.1mol·L-1,向混合溶液中滴加某溶液Z(0.1mol·L-1氢氧化钠或硫酸溶液)至溶液呈中性,所得沉淀的物质的量如图所示,则X、Y、Z分别是
1L某混合溶液中,溶质X、Y的浓度都为0.1mol·L-1,向混合溶液中滴加某溶液Z(0.1mol·L-1氢氧化钠或硫酸溶液)至溶液呈中性,所得沉淀的物质的量如图所示,则X、Y、Z分别是