16.(05广东卷)
在密闭容器中,由一定起始浓度的氙(Xe)和F2反应,可得到3种氟化物。各种生成物在平衡体系内的分压与反应温度的关系如右图所示(己知气体的分压之比等于物质的量之比)。
 ==0.00296 mol·L-1·s-1。 ==0.00296 mol·L-1·s-1。
③反应的c(N2O5)=×c(NO2)=×4.98mol·L-1= 2.475mol·L-1,剩余的c(N2O5)为2.525mol·L-1>2.48mol·L-1,说明反应速率比T1慢,即T2<T1。 (3)由N2O4制取N2O5需要是去电子,所以N2O5在阳极区生成。电极反应式见答案。 答案:(1) (2)①不变 ②0.00296 mol·L-1·s-1 ③“<”或“小于” (3)阴极;N2O4+2HNO3-2e-=2N2O5+2H+。 14.(07海南卷)下表是稀硫酸与某金属反应的实验数据:
分析上述数据,回答下列问题: (1)实验4和5表明,________________________ 对反应速率有影响,________________反应速率越快,能表明同一规律的实验还有_________(填实验序号); (2)仅表明反应物浓度对反应速率产生影响的实验有__________________________(填实验序号); (3)本实验中影响反应速率的其他因素还有_____________________,其实验序号是___________。 (4)实验中的所有反应,反应前后溶液的温度变化值(约15 ℃)相近,推测其原因:________________________________ ______________________________________________________。
13.(07广东卷)
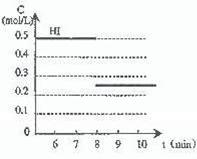
“碘钟”实验中,3I-+
回答下列问题: (1)该实验的目的是___________________________________________________。 (2)显色时间t1=______________。 (3)温度对该反应的反应速率的影响符合一般规律,若在40 ℃下进行编号③对应浓度的实验,显色时间t2的范围为______(填字母)。 (A)<22.0 s (B)22.0 s-44.0 s (C)>44.0 s (D)数据不足,无法判断 (4)通过分析比较上表数据,得到的结论是_________________________________________。 12.(08重庆卷)N2O2-是一种新型硝化剂,其性质和制备受到人们的关注. (1)N2O5与苯发生硝化反应生成的硝基苯的结构简式是 。 (2)2N2O5(g)→4NO2(g)+O2(g);ΔH>0 ①反应达平衡后,若再通入一定量氮气,则N2O5的转化率将 (填“增大”、“减小”、“不变”)。 ②下表为反应在T1温度下的部分实验数据:
则500 s内N2O5的分解速率为 。 ③在T3温度下,反应1 000 s时测得NO2的浓度为4.98 mol·L-1,则T2 T1。 (3)如图所示装置可用于制备N2O5,则N2O5在电解池的 区生成,其电极反应式为 。
|
 的浓度对反应速率的影响。
(2)29.3 s。 (3)A。
的浓度对反应速率的影响。
(2)29.3 s。 (3)A。 -NO2。
-NO2。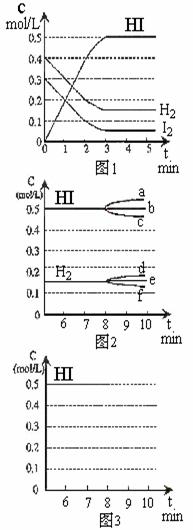
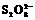 =I3- +2SO42 -的反应速率可以用I3- 与加入的淀粉溶液显蓝色的时间t来度量,t越小,反应速率越大。某探究性学习小组在20 ℃进行实验,得到的数据如下表:
=I3- +2SO42 -的反应速率可以用I3- 与加入的淀粉溶液显蓝色的时间t来度量,t越小,反应速率越大。某探究性学习小组在20 ℃进行实验,得到的数据如下表:
 C(g)+D(g)正反应速率增大的措施是( )
C(g)+D(g)正反应速率增大的措施是( )