20.(12分)随着材料科学的发展,金属钒及其化合物得到了越来越广泛的应用,并被誉为“合金的维生素”。为回收利用含钒催化剂(含有V2O5、VOSO4及不溶性残渣),科研人员最新研制了一种离子交换法回收钒的新工艺,回收率达91.7%以上。
部分含钒物质在水中的溶解性如下表所示:
|
物质 |
VOSO4 |
V2O5 |
NH4VO3 |
(VO2)2SO4 |
|
溶解性 |
可溶 |
难溶 |
难溶 |
易溶 |
该工艺的主要流程如下。
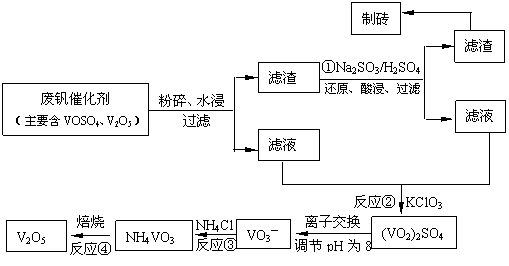 请回答下列问题:
请回答下列问题:
(1)23V在元素周期表位于第 ▲ 周期 ▲ 族。工业上由V2O5 冶炼金属钒常用铝热剂法,其用化学方程式表示为 ▲ 。
(2)反应①的目的是 ▲ 。
(3)该工艺中反应③的沉淀率(又称沉矾率)是回收钒的关键之一,写出该步发生反应的离子方程式 ▲ 。
(4)用已知浓度的硫酸酸化的H2C2O4溶液,滴定(VO2)2SO4溶液,以测定反应②后溶液中含钒量: VO2+ + H2C2O4 + H+ → VO2+ + CO2 + ______。
短线上填写物质的化学式或离子符号后,写出配平后完整的离子方程式。
▲ 。
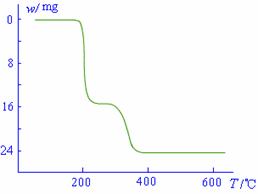 (5)经过热重分析测得:NH4VO3在焙烧过程中,固体质量的减少值(纵坐标)随温度变化的曲线如右图所示。则NH4VO3在分解过程中 ▲ 。
(5)经过热重分析测得:NH4VO3在焙烧过程中,固体质量的减少值(纵坐标)随温度变化的曲线如右图所示。则NH4VO3在分解过程中 ▲ 。
A.先分解失去H2O,再分解失去NH3
B.先分解失去NH3,再分解失去H2O
C.同时分解失去H2O和NH3
D.同时分解失去H2、N2和H2O
 B.氧化还原反应
B.氧化还原反应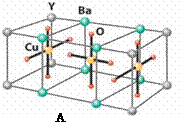 NaNH2+N2O=NaN3+H2O。HN3、浓盐酸混合液可溶解铜、铂、金等不活泼金属,如溶解铜生成CuCl2-。铜和铂的化合物在超导和医药上有重要应用,Cu的化合物A(晶胞如图)即为超导氧化物之一,而化学式为Pt(NH3)2Cl2的化合物有两种异构体,其中B异构体具有可溶性,可用于治疗癌症。
NaNH2+N2O=NaN3+H2O。HN3、浓盐酸混合液可溶解铜、铂、金等不活泼金属,如溶解铜生成CuCl2-。铜和铂的化合物在超导和医药上有重要应用,Cu的化合物A(晶胞如图)即为超导氧化物之一,而化学式为Pt(NH3)2Cl2的化合物有两种异构体,其中B异构体具有可溶性,可用于治疗癌症。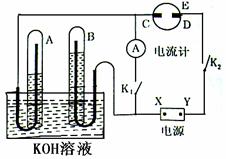 ⑴标出电源的正、负极,X为____▲____, Y为___▲______。
⑴标出电源的正、负极,X为____▲____, Y为___▲______。
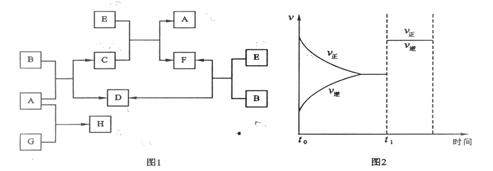 (9分)下列图1中B是一种常见的无色无味的液体。C是一种有磁性的化合物,E是一种无色无味的有毒气体。根据下列图1、图2,回答下列问题:
(9分)下列图1中B是一种常见的无色无味的液体。C是一种有磁性的化合物,E是一种无色无味的有毒气体。根据下列图1、图2,回答下列问题: F(g) + D(g)反应速率和时间的关系如图2所示,那么在t1时速率发生改变的原因可能是 ▲ (填选项字母)。 A.升高温度 B.增大压强 C.加入催化剂
F(g) + D(g)反应速率和时间的关系如图2所示,那么在t1时速率发生改变的原因可能是 ▲ (填选项字母)。 A.升高温度 B.增大压强 C.加入催化剂