23.(10分)
原子序数递增的部分短周期主族元素的原子半径数据如下表:
|
元素 |
A |
B |
D |
E |
F |
G |
M |
N |
P |
|
原子半径/nm |
0.077 |
0.075 |
0.074 |
0.071 |
0.186 |
0.160 |
0.143 |
0.102 |
0.099 |
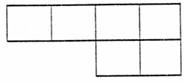 (1)已知A、B、D、E、N、P为非金属元素,在周期表中的位置如下,请将相应元素符号填在表中。
(1)已知A、B、D、E、N、P为非金属元素,在周期表中的位置如下,请将相应元素符号填在表中。
(2)B在周期表中的位置为 ,
AD2的电子式为 。
(3)N的最高价氧化物的水化物与A单质反应的化学方程式为 。
(4)M的最高价氧化物的水化物是药物“胃舒平”的主要成分,可以治疗胃酸过多,反应的离子方程式为 ,F的最高价氧化物的水化物也可以中和胃酸,不用其治疗胃酸过多的原因是 。
 (5)AD2与ND2性质相似,G在ND2中也可以剧烈燃烧,反应的化学方程式为
。
(5)AD2与ND2性质相似,G在ND2中也可以剧烈燃烧,反应的化学方程式为
。
 2C(g)+2D(g)在不同条件下,反应速率分别为
2C(g)+2D(g)在不同条件下,反应速率分别为  2C(气)达到平衡的标志是( )
2C(气)达到平衡的标志是( ) X、Y、Z、W为含有相同电子数的分子或离子,均由原子序数小于10的元素组成。X有5个原子核。通常状况下,W为无色液体。已知:X+Y Z+W
X、Y、Z、W为含有相同电子数的分子或离子,均由原子序数小于10的元素组成。X有5个原子核。通常状况下,W为无色液体。已知:X+Y Z+W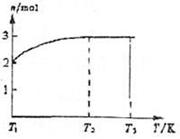 ①温度在T1~T2之间,反应的化学方程式是
。
①温度在T1~T2之间,反应的化学方程式是
。 下图中,P为一可自由滑动的活塞,关闭K,分别向容器A、B中均各充入2molX、2molY,起始时,VA=aL,VB=0.8aL(连通管的体积忽略不计),在相同温度和催化剂存在的条件下,两容器中各自发生下述反应:3X(g)+3Y(g)
2Z(g)+2W(g),达到平衡时,VB=0.6aL。
下图中,P为一可自由滑动的活塞,关闭K,分别向容器A、B中均各充入2molX、2molY,起始时,VA=aL,VB=0.8aL(连通管的体积忽略不计),在相同温度和催化剂存在的条件下,两容器中各自发生下述反应:3X(g)+3Y(g)
2Z(g)+2W(g),达到平衡时,VB=0.6aL。 (14分)
(14分)