0 39810 39818 39824 39828 39834 39836 39840 39846 39848 39854 39860 39864 39866 39870 39876 39878 39884 39888 39890 39894 39896 39900 39902 39904 39905 39906 39908 39909 39910 39912 39914 39918 39920 39924 39926 39930 39936 39938 39944 39948 39950 39954 39960 39966 39968 39974 39978 39980 39986 39990 39996 40004 447348
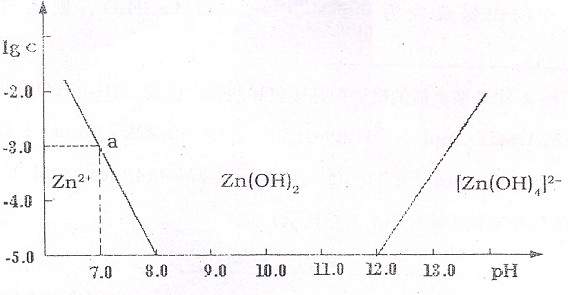
 在密闭容器中进行下列反应:M(g)+N(g)
在密闭容器中进行下列反应:M(g)+N(g) R(g)+2L,此反应符合下面图像,下列叙述正确的是
R(g)+2L,此反应符合下面图像,下列叙述正确的是