16.(10分)用粗锌(含少量Fe等杂质)与稀硫酸反应制氢气,其废液中含有大量的硫酸锌。同学们用制氢气的废液来制取皓矾(ZnSO4·7H2O),并探究其性质。 实验流程如下图所示:
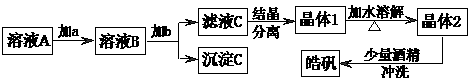
已知:氢氧化物沉淀的pH范围见右表。请回答下列问题:
|
氢氧化物 |
Fe(OH)3 |
Fe(OH)2 |
Zn(OH)2 |
|
开始沉淀pH |
2.7 |
7.6 |
5.7 |
|
完全沉淀pH |
3.7 |
9.6 |
8.0 |
① 加入的试剂a,供选择使用的有:氨水、NaClO溶液、20%的H2O2、浓硫酸、浓硝酸等,应选用 ,其理由是 。
② 加入的试剂b,供选择使用的有: Zn粉、ZnO、Zn(OH)2、ZnCO3、ZnSO4等,应选用 ,其理由是 。
③从晶体l→晶体2,该过程的名称是 。
④在得到皓矾时,向晶体中加入少量酒精洗涤而不用水的原因是 。
⑤称取28.7g ZnSO4·7H2O研细后置于坩埚中小心加热,其固体质量与温度的对应数据见右表。则1000℃时皓矾的反应方程式为 。
|
温度(℃) |
60 |
240 |
930 |
1000 |
|
残留固体质量(g) |
19.7 |
16.1 |
8.1 |
8.1 |


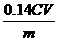 或
或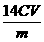 %
% 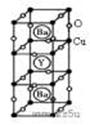 (10分)新型节能材料高温超导体的最先突破是在1987年从新的钇钡铜氧材料的研究开始的。在制备钇钡铜氧高温超导体的同时,偶然得到了副产品--紫色的硅酸铜钡。凑巧的是,后者正是发现于中汗代器物上的被称为“汗紫”的颜料,还发现于秦俑彩绘。钇钡铜氧的晶胞结构如图。研究发现,此高温超导体中的铜元素有两种价态,+2价和+3价。
(10分)新型节能材料高温超导体的最先突破是在1987年从新的钇钡铜氧材料的研究开始的。在制备钇钡铜氧高温超导体的同时,偶然得到了副产品--紫色的硅酸铜钡。凑巧的是,后者正是发现于中汗代器物上的被称为“汗紫”的颜料,还发现于秦俑彩绘。钇钡铜氧的晶胞结构如图。研究发现,此高温超导体中的铜元素有两种价态,+2价和+3价。
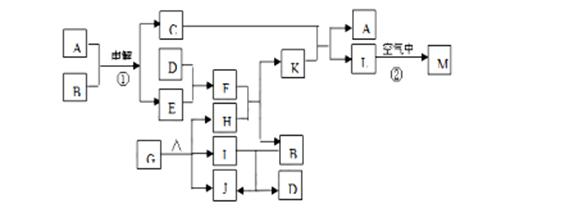 (12分)下图表示各物质之间的转化关系。已知:常温下D、E、F、I、J为气体,H、I、J都为氧化物;C的焰色反应为黄色;M为有颜色的固体。
(12分)下图表示各物质之间的转化关系。已知:常温下D、E、F、I、J为气体,H、I、J都为氧化物;C的焰色反应为黄色;M为有颜色的固体。 P(g)+Q(g);△H>0,请回答下列问题:①若要增大M的转化率,在其它条件不变的情况下可以采取的措施为
P(g)+Q(g);△H>0,请回答下列问题:①若要增大M的转化率,在其它条件不变的情况下可以采取的措施为
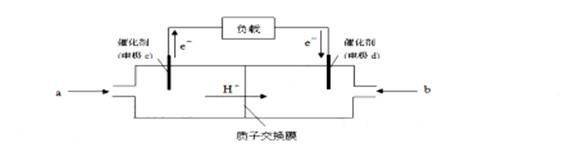 ②下图是某笔记本电脑用甲醇质子交换膜燃料电池的结构示意图。甲醇在催化剂作用下提供质
②下图是某笔记本电脑用甲醇质子交换膜燃料电池的结构示意图。甲醇在催化剂作用下提供质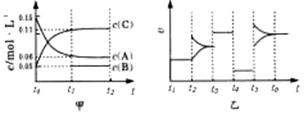 向某密闭容器中加入0.3 molA 、0.1 molC 和一定量的 B 三种气体。一定条件下发生反应,各物质浓度随时间变化如甲图所示[t0-t1阶段 c ( B)未画出]。附图乙为 t2时刻后改变条件平衡体系中反应速率随时间变化的情况,且四个阶段都各改变一种不同的条件并且所用条件均不同。已知,t3-t4阶段为使用催化剂。下列说法正确的是:
向某密闭容器中加入0.3 molA 、0.1 molC 和一定量的 B 三种气体。一定条件下发生反应,各物质浓度随时间变化如甲图所示[t0-t1阶段 c ( B)未画出]。附图乙为 t2时刻后改变条件平衡体系中反应速率随时间变化的情况,且四个阶段都各改变一种不同的条件并且所用条件均不同。已知,t3-t4阶段为使用催化剂。下列说法正确的是: B(g)
+ 2C(g);ΔH=+100akJ·mol-1
B(g)
+ 2C(g);ΔH=+100akJ·mol-1 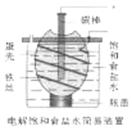 向一定量的Fe、FeO和Fe2O3的混合物中加入120mL 4mol/L的稀硝酸,恰好使混合物完全溶解,放出1.344L NO(标准状况),往所得溶液中加入KSCN溶液,无血红色出现。若用足量的氢气在加热下还原相同质量的混合物,能得到铁的物质的量为
向一定量的Fe、FeO和Fe2O3的混合物中加入120mL 4mol/L的稀硝酸,恰好使混合物完全溶解,放出1.344L NO(标准状况),往所得溶液中加入KSCN溶液,无血红色出现。若用足量的氢气在加热下还原相同质量的混合物,能得到铁的物质的量为