摘要:23. 原子序数递增的部分短周期主族元素的原子半径数据如下表: 元素 A B D E F G M N P 原子半径/nm 0.077 0.075 0.074 0.071 0.186 0.160 0.143 0.102 0.099 (1)已知A.B.D.E.N.P为非金属元素.在周期表中的位置如下.请将相应元素符号填在表中. (2)B在周期表中的位置为 . AD2的电子式为 . (3)N的最高价氧化物的水化物与A单质反应的化学方程式为 . (4)M的最高价氧化物的水化物是药物“胃舒平 的主要成分.可以治疗胃酸过多.反应的离子方程式为 .F的最高价氧化物的水化物也可以中和胃酸.不用其治疗胃酸过多的原因是 . (5)AD2与ND2性质相似.G在ND2中也可以剧烈燃烧.反应的化学方程式为 .
网址:http://m.1010jiajiao.com/timu3_id_398943[举报]
原子序数递增的部分短周期主族元素的原子半径数据如下表:
(1)已知A、B、D、E、N、P为非金属元素,且均不与F、G、M中的任何一种元素同族,在周期表中的相对位置如下,请将相应元素符号填在表中.
(2)B在周期表中的位置为______;AD2的电子式为______.
(3)M的最高价氧化物的水化物是胃药“胃舒平”的主要成分,可以治疗胃酸过多,反应的离子方程式为______.
(4)AD2与ND2性质相似,G在ND2中也可以剧烈燃烧,可能的产物是______,反应的化学方程式为______.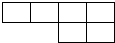
查看习题详情和答案>>
| 元素 | A | B | D | E | F | G | M | N | P |
| 原子半径/nm | 0.077 | 0.070 | 0.066 | 0.064 | 0.186 | 0.160 | 0.143 | 0.104 | 0.099 |
(2)B在周期表中的位置为______;AD2的电子式为______.
(3)M的最高价氧化物的水化物是胃药“胃舒平”的主要成分,可以治疗胃酸过多,反应的离子方程式为______.
(4)AD2与ND2性质相似,G在ND2中也可以剧烈燃烧,可能的产物是______,反应的化学方程式为______.

原子序数递增的部分短周期主族元素的原子半径数据如下表:
(1)已知A、B、D、E、N、P为非金属元素,且均不与F、G、M中的任何一种元素同族,在周期表中的相对位置如下,请将相应元素符号填在表中.
(2)B在周期表中的位置为______;AD2的电子式为______.
(3)M的最高价氧化物的水化物是胃药“胃舒平”的主要成分,可以治疗胃酸过多,反应的离子方程式为______.
(4)AD2与ND2性质相似,G在ND2中也可以剧烈燃烧,可能的产物是______,反应的化学方程式为______ 2MgO+S,Mg+S MgS
MgS
 查看习题详情和答案>>
查看习题详情和答案>>
| 元素 | A | B | D | E | F | G | M | N | P |
| 原子半径/nm | 0.077 | 0.070 | 0.066 | 0.064 | 0.186 | 0.160 | 0.143 | 0.104 | 0.099 |
(2)B在周期表中的位置为______;AD2的电子式为______.
(3)M的最高价氧化物的水化物是胃药“胃舒平”的主要成分,可以治疗胃酸过多,反应的离子方程式为______.
(4)AD2与ND2性质相似,G在ND2中也可以剧烈燃烧,可能的产物是______,反应的化学方程式为______ 2MgO+S,Mg+S
 MgS
MgS 查看习题详情和答案>>
查看习题详情和答案>>
 (2011?福建模拟)原子序数递增的部分短周期主族元素的原子半径数据如下表:
(2011?福建模拟)原子序数递增的部分短周期主族元素的原子半径数据如下表:| 元素 | A | B | D | E | F | G | M | N | P |
| 原子半径/nm | 0.077 | 0.070 | 0.066 | 0.064 | 0.186 | 0.160 | 0.143 | 0.104 | 0.099 |
(2)B在周期表中的位置为
第二周期VA族
第二周期VA族
;AD2的电子式为

(3)M的最高价氧化物的水化物是胃药“胃舒平”的主要成分,可以治疗胃酸过多,反应的离子方程式为
Al(OH)3+3H+═Al3++3H2O
Al(OH)3+3H+═Al3++3H2O
.(4)AD2与ND2性质相似,G在ND2中也可以剧烈燃烧,可能的产物是
MgO、MgS、S
MgO、MgS、S
,反应的化学方程式为2Mg+SO2
2MgO+S,Mg+S
MgS
| ||
| ||
2Mg+SO2
2MgO+S,Mg+S
MgS
.
| ||
| ||
四种短周期元素A、B、C、D的性质或结构信息如下。

信息① 原子半径大小:A>B>C>D
信息② 四种元素之间形成的某三种分子的比例模型及部分性质:
甲:是地球上最常见的物质之一,是包括人类在内所有生命生存的重要资源,也是生物体最重要的组成部分。
乙:无色,无味而易燃,是21世纪的主要能源。
丙:有强氧化性,可以用于消毒杀菌。请根据上述信息回答下列问题。
(1)丙 (写化学式)写出其分子的的电子式 。
(2)写出A原子最外层电子排布式 。将该元素的单质溶于水,形成的平衡体系中所有离子的浓度按由大到小排序:
(3)B形成的单质晶体可能为 。
A.离子晶体 B.分子晶体 C.原子晶体 D.金属晶体
(4)C的同主族元素的单质及其化合物的性质存在着相似性和递变性。下列有关说法正确的是____
A.其气态氢化物的稳定性按H2O、H2S、H2Se、H2Te的顺序依次减弱
B.其氢化物中的键长按O—H、S—H、Se—H、Te—H的顺序依次减小
C.其氢化物的沸点按H2O、H2S、H2Se、H2Te的顺序依次增强
D.其阴离子的还原性按O2–、S2–、Se2–、Te2–的顺序依次增强
(5)与氩原子质子数和电子数均相同的微粒有HCl、H2S、PH3、SiH4,以及还有_______ 、___________等(例举两种即可)
查看习题详情和答案>>
四种短周期元素A、B、C、D的性质或结构信息如下。

信息① 原子半径大小:A>B>C>D
信息② 四种元素之间形成的某三种分子的比例模型及部分性质:
甲:是地球上最常见的物质之一,是包括人类在内所有生命生存的重要资源,也是生物体最重要的组成部分。
乙:无色,无味而易燃,是21世纪的主要能源。
丙:有强氧化性,可以用于消毒杀菌。请根据上述信息回答下列问题。
(1)丙 (写化学式)写出其分子的的电子式 。
(2)写出A原子最外层电子排布式 。将该元素的单质溶于水,形成的平衡体系中所有离子的浓度按由大到小排序:
(3)B形成的单质晶体可能为 。
A.离子晶体 B.分子晶体 C.原子晶体 D.金属晶体
(4)C的同主族元素的单质及其化合物的性质存在着相似性和递变性。下列有关说法正确的是____
A.其气态氢化物的稳定性按H2O、H2S、H2Se、H2Te的顺序依次减弱
B.其氢化物中的键长按O—H、S—H、Se—H、Te—H的顺序依次减小
C.其氢化物的沸点按H2O、H2S、H2Se、H2Te的顺序依次增强
D.其阴离子的还原性按O2–、S2–、Se2–、Te2–的顺序依次增强
(5)与氩原子质子数和电子数均相同的微粒有HCl、H2S、PH3、SiH4,以及还有_______ 、___________等(例举两种即可)

信息① 原子半径大小:A>B>C>D
信息② 四种元素之间形成的某三种分子的比例模型及部分性质:
甲:是地球上最常见的物质之一,是包括人类在内所有生命生存的重要资源,也是生物体最重要的组成部分。
乙:无色,无味而易燃,是21世纪的主要能源。
丙:有强氧化性,可以用于消毒杀菌。请根据上述信息回答下列问题。
(1)丙 (写化学式)写出其分子的的电子式 。
(2)写出A原子最外层电子排布式 。将该元素的单质溶于水,形成的平衡体系中所有离子的浓度按由大到小排序:
(3)B形成的单质晶体可能为 。
A.离子晶体 B.分子晶体 C.原子晶体 D.金属晶体
(4)C的同主族元素的单质及其化合物的性质存在着相似性和递变性。下列有关说法正确的是____
A.其气态氢化物的稳定性按H2O、H2S、H2Se、H2Te的顺序依次减弱
B.其氢化物中的键长按O—H、S—H、Se—H、Te—H的顺序依次减小
C.其氢化物的沸点按H2O、H2S、H2Se、H2Te的顺序依次增强
D.其阴离子的还原性按O2–、S2–、Se2–、Te2–的顺序依次增强
(5)与氩原子质子数和电子数均相同的微粒有HCl、H2S、PH3、SiH4,以及还有_______ 、___________等(例举两种即可)