元素形成单质或化合物时,在邻近两个或多个原子之间的,主要的、强烈的相互作用叫化学键。
一般来说,活泼金属和活泼非金属以离子键相结合。离子键没有方向性和饱和性。由离子键形成的化合物称离子化合物。在离子化合物中还可能存在共价键。
当非金属形成化合物或单质时,通常以共价键结合(除惰性气体单原子分子外)。共价键是靠共用电子对形成的化学键,具有方向性和饱和性。分子中只含有共价键的化合物称共价化合物。
在共价化合物中,不同种原子对共用电子对吸引力不同,所以共用电子对将偏向吸引电子能力强的原子一边,形成了键的极性,称极性共价键。当两种原子吸引电子能力差异越大,则形成的共价键的极性也越强。在单质或某些化合物(如H202)中,同种原子吸引电子能力相同,所以共用电子对不发生偏移,这样的共价键为非极性共价键。形成极性键时,有如下两种情况:
化学键的极性是分子极性产生的原因之一。当分子中所有化学键都是非极性键时,分子为非极性分子。当分子内的化学键为由分子中电荷的空间分布不对称,即各个键的极性无法抵消时为极性分子,由分子中电荷的空间分布对称,使各个键的极性互相抵消时,形成非极性分子。
现列举说明如下:
|
键的极性 |
代表物 |
分子空间构型对称性 |
分子的极性 |
|
非极性键 |
N2、CI2、O2 |
直线型;对称 |
非极性分子 |
|
极性键 |
HCI、 HBr |
直线型、不对称 |
极性分子 |
|
CO2、CS2 |
直线型;对称 |
非极性分子 |
|
|
H2O、H2S |
折线型、不对称 |
极性分子 |
|
|
BF3 |
平面三角型、对称 |
非极性分子 |
|
|
NH3 |
三角锥型、不对称 |
极性分子 |
|
|
CH4、CCI4 |
正四面体;对称 |
非极性分子 |
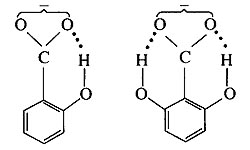
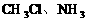 。
。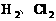 。由________也属于非极性分子。如:
。由________也属于非极性分子。如: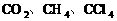
 ;凡键角为109°28′的为_____体,如:
;凡键角为109°28′的为_____体,如: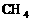 。
。