21A.(12分)物质结构与性质
 聚合铁(简称PFS)化学式为:
聚合铁(简称PFS)化学式为: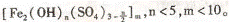 现代污水处理工艺中常利用PFS在水体中形成絮状物,以吸附重金属离子。
现代污水处理工艺中常利用PFS在水体中形成絮状物,以吸附重金属离子。
(l)①PFS中铁显 价,铁原子的电子排布式是 。 ②O元素的第一电离能 N 元素的第一电离能(填“大于”或“小于”) ,原因是 ;水分子中氧原子的杂化轨道类型为 。H2O与H+以配位键结合成H3O+的立体结构为 。
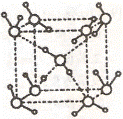
(2)水在不同的温度和压力条件下可以形成11种不同结构的晶体,密度从比水轻的0.92g/cm3扩到约为水的一倍半。冰是人们迄今已知的由一种简单分子堆积出结构花样最多的化合物。其中冰一VII的晶体结构为一个如右上图所示的立方晶胞,每个水分子可与周围 个水分子以氢键结合,晶体中,1mol水可形成 mol氢键。
(3)已知下列元素的电负性数据:H: 2.1, O: 3.5, F:4.0。OF2与水的立体结构相似,但水分子的极性比OF2强得多,其原因有:①OF2中氧原子上有两对孤对电子,抵消了F一O键中共用电子对偏向F而产生的极性;②从电负性上看,
21 B.(12分)实验化学实验室通常用粗锌和稀硫酸反应制氢气,因此在制氢废液中含有大量的硫酸锌。同时,由于粗锌中还含有铁等杂质,使得溶液中混有一定量的硫酸亚铁,为了充分利用制氢废液,常用其制备皓矾(ZnS04·7H20)。某校化学兴趣小组的同学以制氢气的废液为原料来制取皓矾并探究其性质。
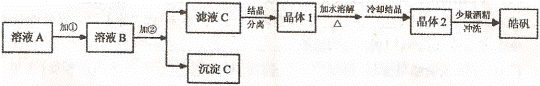 (l)制备皓矾的实验流程如下图所示。
(l)制备皓矾的实验流程如下图所示。
已知:开始生成氢氧化物沉淀到沉淀完全的pH范围分别为:Fe(OH)3 : 2.7一3.7
Fe(OH)2: 7.6一9.6 Zn(OH)2: 5.7一8.0 试回答下列问题: ① 加入的试剂①,供选择使用的有:氨水、NaClO溶液、20%的H202、浓硫酸、浓硝酸等,应选用 ,其理由是 ② 加入的试剂②,供选择使用的有: Zn粉、ZnO、Zn(OH)2、ZnCO3、ZnSO4等,应选用 ,其理由是 ③从晶体l→晶体2,该过程的名称是 。④在得到皓矾时,向晶体中加入少量酒精洗涤而不用水的原因是 。
(2)探究ZnS04·7H20的性质
⑤称取28.7g ZnS04·7H20研细后置于坩埚中小心加热,测得残留固体的质量与温度的对应数据见下表:
|
温度(℃) |
60 |
240 |
930 |
1000 |
|
残留固体质量(g) |
19.7 |
16.1 |
8.1 |
8.1 |
试写出ZnS04·7H20加热到1000℃时的反应方程式 。 ⑥取少量ZnS04·7H20配成溶液向其中逐滴加入Na0H溶液,发现先产生白色沉淀后又逐渐溶解;若改用氨水得到相同的现象。查资料知,氢氧化锌与氢氧化铝均有两性,且锌离子可与氨水形成络合离子[Zn(NH3)4]2+。则Zn(OH)2沉淀中加入NaOH溶液和加氨水均得到无色溶液的离子反应方程式为: (任写一个)。
20.(10分)现代炼锌的方法可分为火法和湿法两大类。火法炼锌是将闪锌矿(主要含ZnS)通过浮选、焙烧使它转化为氧化锌,再把氧化锌和足量焦炭混合,在鼓风炉中加热至1373 ∽1573K ,使锌蒸馏出来。主要反应为:
焙烧炉中:2ZnS+302=2ZnO+ 2S02 ①
鼓风炉中:2C+02=2CO
② ZnO(s)+CO(g)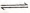 Zn(g)+C02
(g)③
Zn(g)+C02
(g)③
假设鼓风炉体积固定且密闭,随反应的进行鼓风炉内不同时间气态物质的物质的量浓度(mol/L)如下表
|
反应进行时间/min |
CO |
Zn |
CO2 |
|
0 |
0.11 |
0 |
0 |
|
2 |
0.1 |
0.01 |
0.01 |
|
30 |
c1 |
C2 |
C2 |
|
35 |
c1 |
C2 |
C2 |
(l)若保持温度不变,在鼓风炉中增大CO的浓度,K值 填“增大’、“减小”或“不变”);
(2)已知:该温度时,化学平衡常数K=1.0,则表中c1= (写出计算过程) (3)通过改变反应条件,使焙烧炉中反应①的ZnO几乎完全被CO还原,焙烧炉和鼓风炉消耗的O2的体积比不超过 。
(4)若起始浓度不变,通过改变反应条件,达平衡时鼓风炉中反应③CO的转化率为80%,此时该反应的平衡常数K= ,此时焙烧炉和鼓风炉消耗的O2的体积比大于 。
16.(8分)常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表:
|
实验编号 |
HA物质的量浓度(mol/L) |
NaOH物质的量浓度(mol/L) |
混合溶液的pH |
|
① |
0.1 |
0.1 |
pH = 9 |
|
② |
C |
0.2 |
pH = 7 |
|
③ |
0.2 |
0.1 |
pH < 7 |
请回答:
(l)从①组情况分析, HA是强酸还是弱酸
(2)②组情况表明,c 0.2(选填“大于”、“小于”或“等于”)。混合液中离子浓度c(A一)与c(Na+)的大小关系是
(3)从③组实验结果分析,说明HA的电离程度 NaA的水解程度(选填“大于”、“小于”或“等于”) ,该混合溶液中离子浓度由大到小的顺序是
(4)①组实验所得混合溶液中由水电离出的。c(OH-)= mol·L-1。写出该混合溶液中下列算式的精确结果(不能作近似计算)。c(Na+)一c(A-)= mol·L-1, c(OH-)一c(HA) = mol·L-1
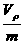 ②
②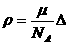 ③
③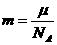 ④
④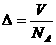 其中正确的是( )
其中正确的是( ) B.碳酸钠水解:CO2-3+2H2O H2CO3+2OH-
B.碳酸钠水解:CO2-3+2H2O H2CO3+2OH-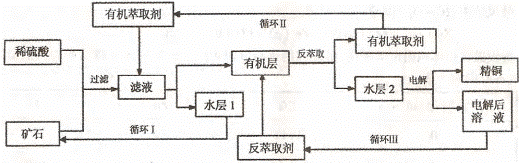
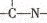 三种基团,无环状结构,三种基团的数目关系为n3 =
。若A的相对分子质量为116,上述基团连接时碳原子跟碳原子相连,则A的结构简式是
三种基团,无环状结构,三种基团的数目关系为n3 =
。若A的相对分子质量为116,上述基团连接时碳原子跟碳原子相连,则A的结构简式是