网址:http://m.1010jiajiao.com/timu3_id_391346[举报]
 新交通法规定酒驾一次扣12分.如图为交警对驾驶员是否饮酒进行检测.其原理如下:2CrO3(红色)+3C2H5OH+3H2SO4=Cr2(SO4)3(绿色)+3CH3CHO+6H2O该反应的氧化剂是( )
新交通法规定酒驾一次扣12分.如图为交警对驾驶员是否饮酒进行检测.其原理如下:2CrO3(红色)+3C2H5OH+3H2SO4=Cr2(SO4)3(绿色)+3CH3CHO+6H2O该反应的氧化剂是( )(12分) 恒容密闭容器中,某化学反应2A  B+D在四种不同条件下进行,B、D起始浓度为0,反应物A的浓度(mol/L)随反应时间(min)的变化情况如下表:
B+D在四种不同条件下进行,B、D起始浓度为0,反应物A的浓度(mol/L)随反应时间(min)的变化情况如下表:
| 实验序号 | 浓度(mol/L) | 时间(min) | |||||||
| 0 | 10 | 20 | 30 | 40 | 50 | 60 | |||
| 1 | 温 度 | 8000C | 1.0 | 0.80 | O.64 | 0.57 | 0.50 | 0.50 | 0.50 |
| 2 | 8000C | C2 | 0.60 | 0.50 | 0.50 | 0.50 | 0.50 | 0.50 | |
| 3 | 8000C | C3 | 0.92 | 0.75 | 0.63 | 0.60 | 0.60 | 0.60 | |
| 4 | 8200C | 1.0 | 0.40 | 0.25 | 0.20 | 0.20 | 0.20 | 0.20 | |
(1)在实验1,反应在前20min内用B的浓度变化来表示的平均速率
为 mol/(L·min)。
(2)在实验2,A的初始浓度c2= mol/L,反应在 20分钟内就达到
平衡,可推测实验2中还隐含的条件是 。
(3)设实验3的反应速率为υ3,实验1的反应速率为υ1(用同种物质的浓度变
化表示),则达到平衡时υ3 υ1(填>、=、<=)
且c3 = mol/L。
(4)比较实验4和实验1,可推测该反应是 反应(选填“吸热”、“放热”)。
(5) 800℃时,反应2A
 B+D的平衡常数= ,
B+D的平衡常数= ,实验2中达到平衡时A的转化率= 。 查看习题详情和答案>>
酒后驾车是引发交通事故的重要原因。公安部交通管理局新修订的《机动车驾驶证申领和使用规定》于2010年4月1日起正式实行,对酒后驾车加倍处罚,一次性扣12分。交警对驾驶员进行呼气酒精检测的原理是:橙色的K2Cr2O7酸性水溶液与乙醇反应,迅速生成蓝绿色的Cr3+。下列对乙醇的描述与此测定原理有关的是( )
①乙醇沸点低 ②乙醇密度比水小 ③乙醇有还原性 ④乙醇是烃的含氧化合物
A.②④ B.②③ C.①③ D.①④
查看习题详情和答案>>
(12分)分子筛可用于物质的分离提纯。某种型号的分子筛的工业生产流程可简单表示如下:
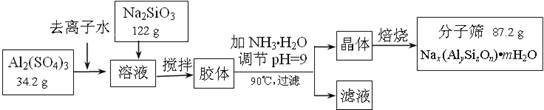
(1)在加NH3·H2O调节pH的过程中,若pH控制不当会有Al(OH)3生成。已知常温下,Al(OH)3浊液的pH=3,其Ksp=1×10-36,则其中c(Al3+)= ▲ 。
(2)生产流程中所得滤液的主要成分为 ▲ (写化学式)。
(3)假设生产流程中铝元素和硅元素均没有损耗,钠原子的利用率为10%,试通过计算确定该分子筛的化学式(写出计算过程)。
(4)分子筛的孔道直径为4Å称为4A型分子筛;当Na+被Ca2+取代时就制得5A型分子筛,当Na+被K+取代时就制得3A型分子筛。要高效分离正丁烷(分子直径为4.65Å)和异丁烷(分子直径为5.6Å)应该选用 ▲ 型的分子筛。
查看习题详情和答案>>
(12分)现用质量分数为98%、密度为1.84 g·cm-3的浓硫酸来配制500 mL、0.2 mol·L-1的稀硫酸。可供选择的仪器有:①玻璃棒 ②烧瓶 ③烧杯 ④托盘天平 ⑤量筒 ⑥药匙
请完成下列问题:
(1)上述仪器中,在配制稀硫酸时用不到的有________(填代号),
除上述仪器外,还缺少的必要仪器是
(2)经计算,需浓硫酸的体积为________,现有①10 mL ②25 mL ③50 mL ④100 mL四种规格的量筒,你选用的量筒是________(填代号)。
(3)在配制过程中,其他操作都准确,下列操作中错误的是_____ ___________,能引起误差偏高的有_____ ___(填代号)。
①洗涤量取浓硫酸后的量筒,并将洗涤液转移到容量瓶中②未等稀释后的H2SO4溶液冷却至室温就转移到容量瓶中 ③将浓硫酸直接倒入烧杯,再向烧杯中注入蒸馏水来稀释浓硫酸 ④定容时,加蒸馏水超过标线,又用胶头滴管吸出 ⑤转移前,容量瓶中含有少量蒸馏水 ⑥定容摇匀后,发现液面低于标线,又用胶头滴管加蒸馏水至标线 ⑦定容时,俯视标线