摘要:(A)现有部分短周期元素的性质或原子结构如下表: 元素编号 元素性质或原子结构 A 单质能与水剧烈反应.所得溶液呈强碱性 B 最外层电子数是次外层电子数的3倍 C L层有三个未成对电子 D 元素最高正价是+7价 (1)写出A与水反应的化学方程式 . (2)元素A与元素D形成一种化合物AD.写出该化合物的电子式 (用元素符号表示) (3)元素B与元素C相比.非金属性较强的是 .下列表述中能证明这一事实的是 A.常温下B的氢化物和C氢化物状态不同 B.原子半径B大于C C.一定条件下B和C的单质能发生反应.C被氧化. (4)探寻物质的性质差异性是学习的重要方法之一.A.B.C.D四种元素的单质中化学性质明显不同于其他三种单质的是 .理由 . (B)现有部分短周期元素的性质或原子结构如下表: 元素编号 元素性质或原子结构 A 单质能与水剧烈反应.所得溶液呈弱酸性 B L层p电子数和s电子数相等 C 第二周期元素的原子中半径最大 D M层有两个未成对电子 (1)写出A与水反应的化学方程式 . (2)元素B和氢元素形成化合物H4B.写出该化合物的电子式 . (3)元素A与元素D相比.非金属性较强的是 .下列表述中能证明这一事实的是 A.常温下A单质的颜色比D单质的颜色深. B.A的气态氢化物比D的气态氢化物稳定 C.离子半径.A大于D (4)探寻物质的性质差异性是学习的重要方法之-.A.B.C.D四种元素的单质中化学性质明显不同于其他三种单质的是 .理由 .
网址:http://m.1010jiajiao.com/timu3_id_383206[举报]
(A)现有部分短周期元素的性质或原子结构如下表:

(1)元素T的原子最外层共有________种不同运动状态的电子.元素X的一种同位素可测定文物年代,这种同位素的符号是________.
(2)元素Y与氢元素形成一种离子YH![]() ,写出该微粒的电子式________(用元素符号表示).
,写出该微粒的电子式________(用元素符号表示).
(3)元素Z与元素T相比,非金属性较强的是________(用元素符号表示),下列表述中能证明这一事实的是________.
a.常温下Z的单质和T的单质状态不同
b.Z的氢化物比T的氢化物稳定
c.一定条件下Z和T的单质都能与氢氧化钠溶液反应
(4)探寻物质的性质差异性是学习的重要方法之一.T、X、Y、Z四种元素的最高价氧化物的水化物中化学性质明显不同于其他三种酸的是________,理由是________.
(B)现有部分短周期元素的性质或原子结构如下表:

(1)写出元素X的离子结构示意图________.写出元素Z的气态氢化物的电子式________(用元素符号表示).
(2)写出Y元素最高价氧化物水化物的电离方程式________.
(3)元素T与氯元素相比,非金属性较强的是________(用元素符号表示),下列表述中能证明这一事实的是________.
a.常温下氯气的颜色比T单质的颜色深
b.T的单质通入氯化钠水溶液不能置换出氯气
c.氯与T形成的化合物中氯元素呈正价态
(4)探寻物质的性质差异性是学习的重要方法之一.T、X、Y、Z四种元素的单质中化学性质明显不同于其他三种单质的是________,理由是________.
现有部分短周期元素的性质或原子结构如下表:
(1)写出元素Z的气态氢化物的电子式
 (用相关元素符号表示),该氢化物VESPR模型是
(用相关元素符号表示),该氢化物VESPR模型是
(2)Y元素的价电子排布式
(3)元素T与氯元素相比,非金属性较强的是
a.常温下氯气的颜色比T单质的颜色深
b.T的单质通入氯化钠水溶液不能置换出氯气
c.氯与T形成的化合物中氯元素呈正价态
d.T的氢化物的沸点高于HCl.
查看习题详情和答案>>
| 元素编号 | 元素性质或原子结构 |
| T | 单质能与水剧烈反应,所得溶液呈弱酸性 |
| X | L层p电子数比s电子数多2个 |
| Y | 第三周期元素的简单离子中半径最小 |
| Z | L层有三个未成对电子 |


四面体型
四面体型
.(2)Y元素的价电子排布式
3s23p1
3s23p1
.(3)元素T与氯元素相比,非金属性较强的是
F
F
(用元素符号表示),下列表述中能证明这一事实的是c
c
.a.常温下氯气的颜色比T单质的颜色深
b.T的单质通入氯化钠水溶液不能置换出氯气
c.氯与T形成的化合物中氯元素呈正价态
d.T的氢化物的沸点高于HCl.
现有部分短周期元素的性质或原子结构如下表:
(1)元素X的一种单质在生活中常用作饮水机的消毒剂,该单质的化学式是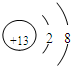
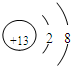 .
.
(2)元素Y与氢元素形成一种离子YH4+,请写出检验溶液中存在该离子的实验操作、现象和结论
(3)写出Z元素最高价氧化物对应的水化物与NaOH溶液反应的离子方程式为
(4)元素X与元素Y相比,非金属性较强的是
a.Y的氢化物可在纯X2中燃烧生成X的氢化物和Y2
b. X的单质比Y的单质更容易与H2 化合
c.X与Y形成的化合物中Y元素呈正价态.
查看习题详情和答案>>
| 元素编号 | 元素性质或原子结构 |
| X | 最外层电子数是次外层电子数的3倍 |
| Y | 常温下单质为双原子分子,其氢化物水溶液呈碱性 |
| Z | 第三周期元素的简单离子中半径最小 |
O3
O3
,元素Z的离子结构示意图为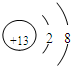
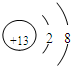
(2)元素Y与氢元素形成一种离子YH4+,请写出检验溶液中存在该离子的实验操作、现象和结论
取少量溶液(或待测液)于试管中,滴加适量浓NaOH溶液后加热,将湿润的红色石蕊试纸沾在玻璃棒上靠近试管口部,若试纸变蓝,说明溶液中存在该离子,反之,不存在该离子
取少量溶液(或待测液)于试管中,滴加适量浓NaOH溶液后加热,将湿润的红色石蕊试纸沾在玻璃棒上靠近试管口部,若试纸变蓝,说明溶液中存在该离子,反之,不存在该离子
.(3)写出Z元素最高价氧化物对应的水化物与NaOH溶液反应的离子方程式为
Al(OH)3+OH-=AlO2-+2H2O
Al(OH)3+OH-=AlO2-+2H2O
.(4)元素X与元素Y相比,非金属性较强的是
O
O
(用元素符号表示),下列表述中能证明这一事实的是a,b,c
a,b,c
.a.Y的氢化物可在纯X2中燃烧生成X的氢化物和Y2
b. X的单质比Y的单质更容易与H2 化合
c.X与Y形成的化合物中Y元素呈正价态.
现有部分短周期元素的性质或原子结构如下表:
(1)元素T的原子最外层共有
(2)元素Y与氢元素形成一种离子YH4+,写出该微粒发生水解反应的离子方程式
(3)元素Z与元素T相比,非金属性较强的是
a.常温下Z的单质和T的单质状态不同
b.Z的氢化物比T的氢化物稳定
c.一定条件下Z和T的单质都能与氢氧化钠溶液反应
(4)探寻物质的性质差异性是学习的重要方法之一.T、X、Y、Z四种元素的最高价氧化物水化物中化学性质明显不同于其他三种酸的是
查看习题详情和答案>>
| 元素编号 | 元素性质或原子结构 |
| T | M层p电子数比s电子数多2个 |
| X | 最外层电子数是次外层电子数的2倍 |
| Y | 常温下单质为双原子分子,其氢化物水溶液呈碱性 |
| Z | 元素最高正价是+7价 |
6
6
种不同运动状态的电子.写出X原子的电子排布式1s22s22p2
1s22s22p2
.(2)元素Y与氢元素形成一种离子YH4+,写出该微粒发生水解反应的离子方程式
NH4++H2O?NH3?H2O+H+
NH4++H2O?NH3?H2O+H+
.(3)元素Z与元素T相比,非金属性较强的是
Cl
Cl
用元素符号表示),下列表述中能证明这一事实的是b
b
.a.常温下Z的单质和T的单质状态不同
b.Z的氢化物比T的氢化物稳定
c.一定条件下Z和T的单质都能与氢氧化钠溶液反应
(4)探寻物质的性质差异性是学习的重要方法之一.T、X、Y、Z四种元素的最高价氧化物水化物中化学性质明显不同于其他三种酸的是
H2CO3
H2CO3
,理由是H2CO3为弱酸性或非氧化性酸
H2CO3为弱酸性或非氧化性酸
.现有部分短周期元素的性质或原子结构如下表:
完成下列问题:
(1)元素T在周期表中位于第
(2)T、X、Y、Z、M原子半径由大到小的顺序是
(3)元素Z与M可形成4原子18电子的分子,该分子的电子式是
 .
.
(4)元素Z与元素T相比,非金属性较强的是
a.常温下Z的单质和T的单质状态不同
b.Z的氢化物比T的氢化物稳定
c. Z的氢化物沸点比T的氢化物沸点高
d.Z单质可将T单质从其氢化物水溶液中置换出来
(5)Y、Z、M可以形成一种盐,此盐中M、Y、Z元素的原子的个数比为4:2:3,该盐的水溶液中离子浓度由大到小的顺序是
(6)右图为元素X与Z形成的化合物分子XZ2的晶胞结构,在该晶胞中,离每一个XZ2最近的XZ2有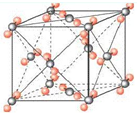
已知该晶胞的边长为a cm,XZ2的摩尔质量为M g/mol,阿伏伽德罗常数为NA.则该晶胞的密度为
查看习题详情和答案>>
| 元素编号 | 元素性质或原子结构 |
| T | M层上的电子数是原子核外电子层数的2倍 |
| X | 最外层电子数是次外层电子数的2倍 |
| Y | 常温下单质为双原子分子,其氢化物的水溶液呈碱性 |
| Z | 原子最外层电子数是次外层的三倍 |
| M | 与X、Y、Z既能形成10电子分子又能形成18电子分子 |
(1)元素T在周期表中位于第
3
3
周期第16
16
纵行.(2)T、X、Y、Z、M原子半径由大到小的顺序是
S>C>N>O>H
S>C>N>O>H
.(3)元素Z与M可形成4原子18电子的分子,该分子的电子式是


(4)元素Z与元素T相比,非金属性较强的是
O
O
(用元素符号表示),下列表述中能证明这bd
bd
.a.常温下Z的单质和T的单质状态不同
b.Z的氢化物比T的氢化物稳定
c. Z的氢化物沸点比T的氢化物沸点高
d.Z单质可将T单质从其氢化物水溶液中置换出来
(5)Y、Z、M可以形成一种盐,此盐中M、Y、Z元素的原子的个数比为4:2:3,该盐的水溶液中离子浓度由大到小的顺序是
c(NO3-)>c(NH4+)>c(H+)>c(OH-)
c(NO3-)>c(NH4+)>c(H+)>c(OH-)
,已知该盐溶液的pH值为5,则该盐溶液中水电离出的氢离子浓度为10-5mol/L
10-5mol/L
.(6)右图为元素X与Z形成的化合物分子XZ2的晶胞结构,在该晶胞中,离每一个XZ2最近的XZ2有
12
12
个,若
已知该晶胞的边长为a cm,XZ2的摩尔质量为M g/mol,阿伏伽德罗常数为NA.则该晶胞的密度为
4M/(a3NA)
4M/(a3NA)
g/cm3.(写出表达式)