27(11分)某化学兴趣小组利用细废铁屑制取FeCl3•6H2O晶体。主要步骤如下:
① 往工业废铁屑中加入适量的纯碱溶液,加热数分钟,用倾析法洗净废铁屑。
② 洗净后的废铁屑放在烧杯内,用过量的工业盐酸浸泡至不再产生气泡,过滤。
③ 按下图组装仪器,并检查装置的气密性,将②得到的滤液放入试剂瓶B中。
④ 在石墨电极X、Y上连接直流电源,通电,待FeCl2全部被氧化后,断开电源。
⑤ 试剂瓶B中的溶液经过一系列操作,可得FeCl3•6H2O晶体。
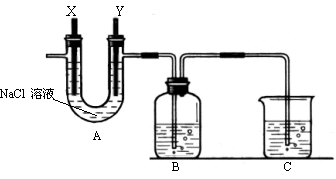
请回答下列问题: (1)步骤①的目的是 ,其中加热的作用是 。 (2)A中的X极应连接电源的 极;B中溶液颜色的变化 , 反应离子方程式是 。 (3)为检验B中FeCl2已全部转化为FeCl3,可以选用的试剂是 。 A、溴水 B、酸性KMnO4溶液 C、KSCN溶液 D、NaOH溶液 (4)在整个实验过程中,盐酸必须保持过量,主要原因是 。 (5)C中的烧杯应该盛放的是 。 (6)由步骤⑤试剂瓶B中的溶液制得FeCl3•6H2O晶体,需要进行的操作依次是(填序号) 。 A、加热浓缩 B、洗涤 C、过滤 D、冷却结晶
28(12分)某课外小组对一些金属单质和化合物的性质进行研究。
(1)下表为“铝与氯化铜溶液反应”实验报告的一部分:
|
实验步骤 |
实验现象 |
|
将打磨过的铝片(过量)放入一定浓度的CuCl2溶液中 |
产生气泡,析出疏松的红色固体,溶液逐渐变为无色 |
|
反应结束后分离出溶液备用 |
|
|
红色固体用蒸馏水洗涤后,置于潮湿空气中 |
一段时间后固体由红色变为绿色[主要成分为Cu2(OH)2CO3] |
按反应类型写出实验中发生反应的化学方程式各一个(是离子反应的只写离子方程式)
置换反应____________________________________;
化合反应____________________________________。
(2)用石墨作电极,电解上述实验分离出的溶液,两极产生气泡。持续电解,在阴极附近的溶液中还可观察到的现象是_________________________________________。解释此现象的离子方程式是_____________________________________
_________________________________________。
(3)工业上可用铝与钦锰矿(主要成分为MnO2)反应来冶炼金属锰。
①用铝与软锰矿冶炼锰的原理是(用化学方程式表示) ___________________________。
②MnO2在H2O2分解反应中作催化剂。若将适量MnO2加入酸化后的H2O2溶液中,MnO2溶解产生Mn2+,该反应的离子方程式是______________________________________。
 2Cu↓+O2 ↑+4H+
(2分)
2Cu↓+O2 ↑+4H+
(2分)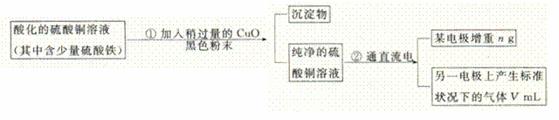 回答下列问题:
回答下列问题: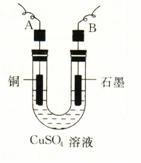 (1)加入CuO的作用是
。
(1)加入CuO的作用是
。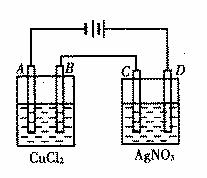 21(6分)右图为以惰性电极进行电解:
(1)写出A、B、C、D各电极上的电极方程式:
A________________________________
B________________________________
C________________________________
D________________________________
(2)在A、B、C、D各电极上析出生成物的物质的量比为______________________。
21(6分)右图为以惰性电极进行电解:
(1)写出A、B、C、D各电极上的电极方程式:
A________________________________
B________________________________
C________________________________
D________________________________
(2)在A、B、C、D各电极上析出生成物的物质的量比为______________________。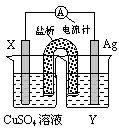

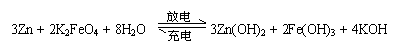 高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压。高铁电池的总反应为:
高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压。高铁电池的总反应为: + 4H2O
+ 4H2O