27.(14分)X、Y、Z为原子序数由小到大排列的三种短周期元素。已知:X、Y的气态氢化物分子具有相同的电子数;Y与Z同主族;XY2是非极性分子,其晶体可用作人工降雨。
请回答:
(1)Z的最高价氧化物对应水化物W是重要的化工原料。W的化学式为 ;
工业制造W的生产过程主要分为三个阶段。
①D 101kPa时,3.2g Z的固体单质完全燃烧可放出29.7kJ的热量,写出能够表示该固体单质燃烧热的热化学方程式 ;
②在接触氧化阶段,为提高ZY2的转化率,从理论上判断,应选择的条件是低温和高压。从下表给出不同温度、压强下ZY2平衡转化率的实验数据进行分析,结合工业生产的实际,应选择适合的温度和压强是(选填字母) ;
A.400℃~500℃ 10 MPa B.400℃~500℃ 1 MPa
C.500℃~600℃ 10 MPa D.400℃~500℃ 0.1 MPa
 压强/MPa 压强/MPa转化率/% 温度/℃ |
0.1 |
0.5 |
1 |
10 |
|
400 |
99.2 |
99.6 |
99.7 |
99.9 |
|
500 |
93.5 |
96.9 |
97.8 |
99.3 |
|
600 |
73.7 |
85.8 |
89.5 |
96.4 |
③在吸收阶段,为尽可能提高ZY3的吸收效率,工业上选择的吸收剂是(选填字母)
。
A.水 B.0.5mol/L的硫酸 C.98.3%的硫酸 D.浓氨水
(2)已知X与XY都是工业上常用的还原剂。
①写出X单质与W的浓溶液反应的化学方程式 ;
②500℃,11.2 L(标准状况)ZY2在催化剂作用下与XY发生化学反应。若有2×6.02×1023个电子转移时,该反应的化学方程式是 。
9.下列有关阿伏加德罗常数(NA)的叙述中,正确的是
A.常温常压下22.4L C2H4中含有6NA个C-H键
B.电解精炼铜中当有6.4g精铜析出时,电路中有0.2NA个电子转移
C.用V2O5作催化剂,在密闭容器中加热1mol O2和2mol SO2可生成2NA个SO3分子
D.18g D2O中含有的电子数为10NA
|
水处理的新技术。已知反应Fe2O3+3Na2O2 2Na2FeO4+Na2O有关该反应的叙述正确的是 ( )
|
B.Na2FeO4是一种氧化性比Na2O2更强的氧化剂
C.3molNa2O2发生反应时,有12mol电子发生转移
D.在Na2FeO4中Fe为+6价,其还原产物为Fe3+,Fe3+水解生成氢氧化铁胶体还有净水作用

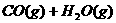

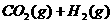
 ,在催化剂存在的条件下,高温加热,发生如下反应:
,在催化剂存在的条件下,高温加热,发生如下反应: ;
;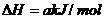
 ,下列说法正确的是( )
,下列说法正确的是( )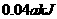
 、
、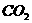 、
、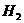 的浓度都相等
的浓度都相等 (2)
(2) (3分)(3)0.9%(3分)
(3分)(3)0.9%(3分)