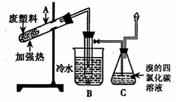
24.(6分)某些废旧塑料可采用下列方法处理:将废塑料隔
绝空气加强热,使其变成有用的物质,实验装置如右图。加
热聚丙烯废塑料得到的产物如下表:
|
产物 |
氢气 |
甲烷 |
乙烯 |
丙烯 |
苯 |
甲苯 |
碳 |
|
质量分数(%) |
12 |
24 |
12 |
16 |
20 |
10 |
6 |
 (1)试管A中残余物有多种用途,如下列转化就可制取高聚物聚乙块。
(1)试管A中残余物有多种用途,如下列转化就可制取高聚物聚乙块。
A中残留物
写出反应②、③的化学方程式:② ▲ 、 ③ ▲ ;
(2)试管B收集到的产品中,有一种能使酸性高锰酸钾溶液褪色的物质,其一氯代物有
▲ 种;
(3)锥形瓶C中观察到的现象是 ▲ ,经溴的四氯化碳溶液充分吸收,剩余气体经干燥后的平均相对分子质量为 ▲ ;
(4)写出C中逸出的气体在工业上的一种用途 ▲ 。
22.(6分)常温下,某学生用两片质量相等、外形相同、且表面均经过砂纸打磨(完全除掉氧化膜)的铝片,分别与等体积的c(H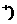 均为3 mol/L的稀盐酸和稀硫酸反应。
均为3 mol/L的稀盐酸和稀硫酸反应。
(1)写出反应的离子方程式 ▲ ;
(2)实验过程中观察反应进行到1、2、5、15、20 min时铝片与酸反应的情况,实验结果如下表:
|
反应进程(min) |
1 |
2 |
5 |
15 |
20 |
|
盐酸 |
少量气泡 |
较多气泡 |
大量气泡 |
反应强烈 |
铝片耗尽 |
|
硫酸 |
均无明显现象(无气泡产生) |
通过上述实验可知,铝片与盐酸和硫酸反应存在较大差异。这和课本中“铝能与盐酸和稀硫酸反应生成氢气”的说法不一致。假如你将开展实验探究铝片与稀盐酸和稀硫酸反应差异的原因,并设计实验,你将对差异的原因作出哪些假设或猜想(填2种即可):
① 假设(猜想)一: ▲ ,② 假设(猜想)二: ▲ ;
(3)请设计实验验证你的假设或猜想:
① 假设(猜想)一: ▲ ,② 假设(猜想)二: ▲ ;
(4)现欲加快铝与盐酸反应的速率,可采取的方法或措施是 ▲ (任写一种)。
21.(7分) 现有三位同学分别利用浓盐酸、MnO2共热制Cl2,并用Cl2和Ca(OH)2反应制取少量漂白粉,设计了三套实验装置:
|


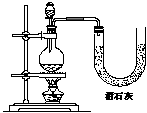
已知温度稍高即发生如下副反应:6Cl2+6 Ca(OH)2=Ca(ClO3)2+5CaCl2+6H2O
(1)请从以下几个方面对上述甲、乙、丙三套装置的优缺点作出评价,并选择符合题目要求的选项编号填在空格内:① 不容易控制反应速率;② 容易控制反应速率;③ 有副反应发生;④ 可防止副反应发生;⑤ 污染环境;⑥ 可防止污染环境。
|
|
优点 |
缺点 |
|
甲装置 |
▲ |
▲ |
|
乙装置 |
▲ |
▲ |
|
丙装置 |
▲ |
▲ |
(2)请从上述装置的A-G的组成中选取合理的部分组装一套较完善的实验装置,装置各部分的连接顺序(按气流从左到右的方向)是 ▲ 。
 NH4+ + NH2- (2分) (2)A、D (2分)
NH4+ + NH2- (2分) (2)A、D (2分)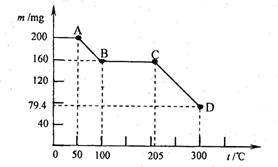 25.(4分)下图是200 mg MnC2O4·2H2O晶体放在坩埚里加热分解时,所得固体产物的质量(m)随温度(t)变化的关系曲线(已知草酸锰不稳定,但其中锰元素的化合价在300oC以下不变)。试回答下列问题:
25.(4分)下图是200 mg MnC2O4·2H2O晶体放在坩埚里加热分解时,所得固体产物的质量(m)随温度(t)变化的关系曲线(已知草酸锰不稳定,但其中锰元素的化合价在300oC以下不变)。试回答下列问题: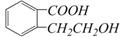 ,它可以通过不同的反应得到下列物质:
,它可以通过不同的反应得到下列物质: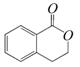 C.
C.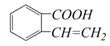 D.
D.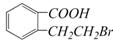
 (4)写出两种既可以看作酯类又可以看作酚类,且分子中苯环上连有三种取代基的A的同分异构体的结构简式(要求这两种同分异构体中苯环上的取代基至少有一种不同)
(4)写出两种既可以看作酯类又可以看作酚类,且分子中苯环上连有三种取代基的A的同分异构体的结构简式(要求这两种同分异构体中苯环上的取代基至少有一种不同)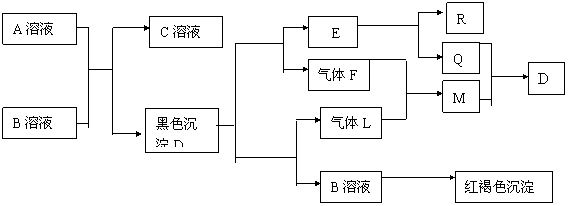 素在两种化合物中的化合价不同。
素在两种化合物中的化合价不同。 H++A2-。试回答下列问题:
H++A2-。试回答下列问题: