28、⑴2I-+4H++MnO2=Mn2++2H2O+I2
2IO3-+5HSO3-=3H++5SO42-+H2O+I2 氧化 还原
实验目的:2.认识碘单质的检验方法。
实验原理:⑵用NaHSO3还原KIO3生成单质碘,再用淀粉检验碘单质的存在
实验用品:试管、滴管,“淮”牌精制盐、亚硫酸氢钠溶液、淀粉溶液
|
实 验 步 骤 |
实验现象 |
化 学 方 程 式 或 实 验 结 论 |
|
1.取食盐少许于一支试管中,加入适量的水,振荡,使食盐全部溶解 |
|
食盐及碘酸钾能溶于水 |
|
2.向上述溶液中滴加适量的亚硫酸钠溶液,振荡 |
|
|
|
3.再向上述溶液中滴加淀粉溶液。振荡,观察现象 |
溶液变成蓝色 |
|
问题讨论(只要阐述的理由和得出的结论不矛盾即给分)
26、
|
③ 2Al+Fe2O3=== 2Fe + Al2O3 (3分,仅条件错得2分)
|
(2)① 2KCl+2H2O====Cl2↑+H2↑+2KOH
(2分,写“电解”可得分,缺条件不得分)
② 3Cl2+6OH-==5Cl-+ClO3-+3H2O (2分)
2. 。
实验原理:(提示:结合题中信息和实验目的进行分析) 。
实验用品:(提示:实验用品通常包括仪器和药品,根据你设计的实验填写)
。
实验步骤:(用准确、简洁的语言填写下表)
|
实 验 步 骤 |
实验现象 |
化 学 方 程 式 或 实 验 结 论 |
|
|
固体在水中 溶 解 |
|
|
|
溶液出现棕 黄 色 |
2IO3-+5HSO3-=3H++5SO42-+H2O+I2 |
|
|
|
“淮”牌精制盐中含有碘元素。 |
问题讨论:如东有100多km的海岸线,海产品丰富,海产品中或多或少的含有碘元素,而海产品又是如东人的主要副食品,如东人的食用盐中需要加碘吗?说明你的理由
。
28、I、下表是如东某超市出售的“淮牌”加碘精制盐的有关说明:
|
产 品 标 准 号 |
Q/320000JYJ03-2004 |
|
许 可 证 号 |
食盐批字第100070号 |
|
配 料 表 |
精制盐、碘酸钾 |
|
含 碘 量 |
35±15mg/kg |
|
卫生许可证号 |
东卫食字(2005)第00015号 |
|
分 装 日 期 |
见封口 |
|
储 藏 方 法 |
通风、防潮 |
|
食 用 方 法 |
根据烹调所需适量加入 |
|
食品标签认可号 |
苏食签(2002)007号 |
II、下面是某网站上刊出的有关碘及碘的化合物的有关信息:
自然界中碘主要以碘化物和碘酸盐的形式存在。碘在海水中的含量甚微(5×10-8%),但海洋中某些生物如海带、海藻等具有选择性吸收和聚积碘的能力,因而干海藻是碘的一个重要来源。目前世界上碘主要来自智利硝石,其中含碘0.02%-1%,智利硝石中碘主要以碘酸钠(NaIO3)的形式存在。通常情况下碘是一种紫黑色固体,易升华,只能少量溶于水得棕黄色的碘水溶液,但易溶于苯、四氯化碳等有机溶剂,紫色的碘蒸气有刺激性气味,能强烈刺激眼、耳、鼻、气管等粘膜,吸入较多的碘蒸气会发生中毒,甚至造成死亡。碘遇淀粉(面粉的主要成分)会出现明显的蓝色。碘离子(I-)具有明显的还原性,而高价态的碘则具有较强的氧化性:
2NaI+3H2SO4+MnO2=2NaHSO4+MnSO4+2H2O+I2 …………⑴
2NaIO3+5NaHSO3=2Na2SO4+3NaHSO4+H2O+I2 …………⑵
反应⑴是自海藻灰中提取碘的主要反应,反应⑵是自智利硝石中提取碘的主要反应。
根据以上信息,回答下列问题:
⑴反应⑴、反应⑵的离子方程式是(亚硫酸氢钠的电离方程式是:NaHSO3=Na++HSO3-)
反应⑴: ;反应⑵: ;
I2在反应⑴中是 (填“氧化”或“还原”,下同)产物,在反应⑵中是 产物;
⑵请你设计实验探究上述 “淮牌”精制盐中是否真的含有碘元素。
实验名称:探究“淮牌”精制盐中是否含有碘元素
实验目的:1.认识碘酸钾中的碘元素转变成碘单质的化学反应;
 粒子散射实验说明原子核内部具有复杂结构
粒子散射实验说明原子核内部具有复杂结构
 或
或 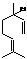
 或
或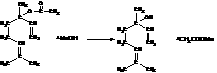
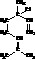
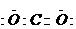 (2分);极性(2分);三角锥形(2分)
(2分);极性(2分);三角锥形(2分)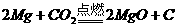 (3分)
(3分)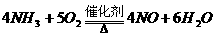 (3分)
(3分) (3分)
(3分)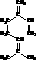 ,也可简写为
,也可简写为 ,其分子式是
,可以发生的化学反应有
(选填序号)。
,其分子式是
,可以发生的化学反应有
(选填序号)。