27.(1)2Mg+CO2====2MgO+C
|
(3)4NH3+5O2====4NO+6H2O; (4)C+4HNO3====CO2↑+4NO2↑+2H2O
(5)2NH4++2e- = 2NH3↑+H2↑
13. 有编号为1、2、3、4的四瓶无色液体,仅知道是1%酚酞、0.1mol/LNaOH溶液、0.1mol/L盐酸和0.1mol/LNaCl溶液,现要求甲、乙、丙、丁四位学生进行鉴别,而且每人只鉴别两瓶溶液,告诉学生鉴别两瓶溶液都正确得满分,只有一瓶正确可以及格。
四位学生的鉴别结果如下:
|
甲 |
1号为0.1mol/L盐酸 |
4号为0.1mol/LNaCl溶液 |
老师评价:四位学 生都及格,但是没 有一个得满分 |
|
乙 |
1号为0.1mol/LNaOH溶液 |
3号为0.1mol/L盐酸 |
|
|
丙 |
1号为1%酚酞 |
2号为0.1mol/L盐酸 |
|
|
丁 |
4号为0.1mol/L盐酸 |
2号为NaOH溶液 |
正确的结论是( )
A. 4号为0.1mol/L盐酸 B.2号为0.1mol/LNaCl溶液
C. 3号为0.1mol/LNaOH溶液 D. 1号为1%酚酞
 ③ 2SO2(g) +
O2 (g) 2SO3(g) △H=-196.6kJ/mol
③ 2SO2(g) +
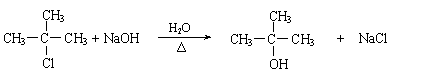
O2 (g) 2SO3(g) △H=-196.6kJ/mol 2MgO,2Mg+CO2
2MgO,2Mg+CO2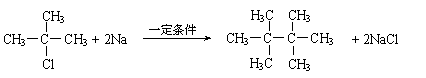
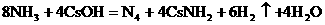 (2分)
(2分) (2分)
(2分)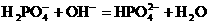 (2分)
(2分)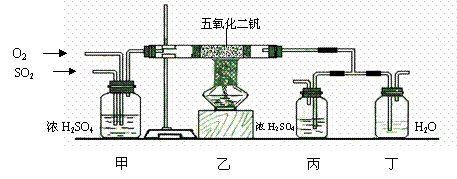 (1)工业上制硫酸的设备分为三大部分,一是沸腾炉、二是接触室、三是吸收塔。在沸腾炉内二硫化亚铁与氧气发生反应,生成二氧化硫;在接触室内有催化剂存在下二氧化硫进一步与氧气化合,生成三氧化硫; 三氧化硫流经吸收塔时,采用98.3%的浓硫酸吸收,三氧化硫与水化合形成硫酸。为研究吸收SO3应选用的物质,仿照工业上制备硫酸的流程设计了下面的实验装置。
(1)工业上制硫酸的设备分为三大部分,一是沸腾炉、二是接触室、三是吸收塔。在沸腾炉内二硫化亚铁与氧气发生反应,生成二氧化硫;在接触室内有催化剂存在下二氧化硫进一步与氧气化合,生成三氧化硫; 三氧化硫流经吸收塔时,采用98.3%的浓硫酸吸收,三氧化硫与水化合形成硫酸。为研究吸收SO3应选用的物质,仿照工业上制备硫酸的流程设计了下面的实验装置。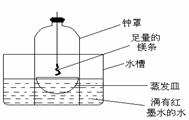 ②乙同学认为,空气中存在大量的氮气,镁也可能和氮气反应。他设计了如下装置进行实验:
②乙同学认为,空气中存在大量的氮气,镁也可能和氮气反应。他设计了如下装置进行实验: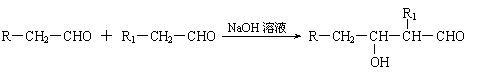 已知:⑴凡与醛基直接相连的碳原子上的氢称为α一H原子,在稀碱溶液的催化作用下,一个醛分子上的α一H原子连接到另一个醛分子的氧原子上,其余部分连接到羰基碳原子上生成羟基醛,如:
已知:⑴凡与醛基直接相连的碳原子上的氢称为α一H原子,在稀碱溶液的催化作用下,一个醛分子上的α一H原子连接到另一个醛分子的氧原子上,其余部分连接到羰基碳原子上生成羟基醛,如:
 ⑶
⑶



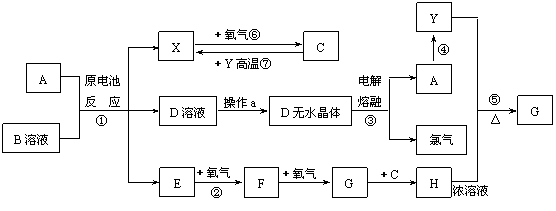 (15分)已知A为常见金属,X、Y为常见非金属,X、E、F、G常温下为气体,C为液体,B是一种盐,受热极易分解,在工农业生产中用途较广(如被用作某些电池的电解质)。现用A与石墨作电极,B的浓溶液作电解质,构成原电池。有关物质之间的转化关系如下图:(注意:其中有些反应的条件及部分生成物被略去)
(15分)已知A为常见金属,X、Y为常见非金属,X、E、F、G常温下为气体,C为液体,B是一种盐,受热极易分解,在工农业生产中用途较广(如被用作某些电池的电解质)。现用A与石墨作电极,B的浓溶液作电解质,构成原电池。有关物质之间的转化关系如下图:(注意:其中有些反应的条件及部分生成物被略去) 中检出组成为
中检出组成为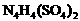 的物质,经测定,该物质易溶于水,在水中以
的物质,经测定,该物质易溶于水,在水中以 和
和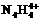 两种离子形式存在,植物的根系极易吸收
两种离子形式存在,植物的根系极易吸收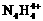 ,但它遇到碱时,会生成一种形似白磷的N4分子,N4分子不能被植物吸收。
,但它遇到碱时,会生成一种形似白磷的N4分子,N4分子不能被植物吸收。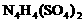 (填“能”或“不能”)和草木灰混合施用。
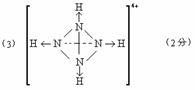
(填“能”或“不能”)和草木灰混合施用。 的空间构型均为四面体,
的空间构型均为四面体, 的结构式为
的结构式为 (
(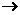 表示共用电子对由N原子单方面提供),白磷(P4)的结构式为
表示共用电子对由N原子单方面提供),白磷(P4)的结构式为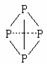 ,请画出
,请画出 的结构式
。
的结构式
。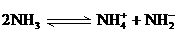 。科学家在液氨中加入氢氧化铯(CsOH)和特殊的吸水剂,使液氨中的
。科学家在液氨中加入氢氧化铯(CsOH)和特殊的吸水剂,使液氨中的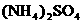 和NH3·H2O的水溶液称为“缓冲溶液”,在此溶液中加入少量的强碱或强酸时,溶液的pH几乎不变,这可由下列离子方程式来说明。
和NH3·H2O的水溶液称为“缓冲溶液”,在此溶液中加入少量的强碱或强酸时,溶液的pH几乎不变,这可由下列离子方程式来说明。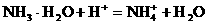 加碱时:
加碱时: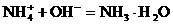
 的大量存在,加少量酸或碱时,溶液中C(H+)与C(OH-)基本保持不变;含有一定量
的大量存在,加少量酸或碱时,溶液中C(H+)与C(OH-)基本保持不变;含有一定量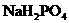 和
和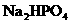 的溶液,也具有缓冲作用,写出此溶液中加入少量强酸或强碱时发生的离子反应方程式:
的溶液,也具有缓冲作用,写出此溶液中加入少量强酸或强碱时发生的离子反应方程式: