摘要: 高温 ② FeCl3 第四周期 Ⅷ族 ③ 2Al+Fe2O3=== 2Fe + Al2O3 通电 加入少量氯酸钾.插上镁条并将其点燃 (2)① 2KCl+2H2O====Cl2↑+H2↑+2KOH (2分.写“电解 可得分.缺条件不得分) ② 3Cl2+6OH-==5Cl-+ClO3-+3H2O
网址:http://m.1010jiajiao.com/timu3_id_37284[举报]
中国政府承诺,到2020年,单位GDP二氧化碳排放比2005年下降40%~50%.
(1)有效“减碳”的手段之一是节能,下列制氢方法最节能的是
A.电解水制氢:2H2O
2H2↑+O2↑
B.高温使水分解制氢:2H2O
2H2↑+O2↑
C.太阳光催化分解水制氢:2H2O
2H2↑+O2↑
D.天然气制氢:CH4+H2O
CO+3H2
(2)CO2可转化成有机物实现碳循环.在体积为1L的密闭容器中,充入1mol CO2和3mol H2,一定条件下反应:
CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ?mol-1,测得CO2和CH3OH(g)的浓度随时间变化如图所示.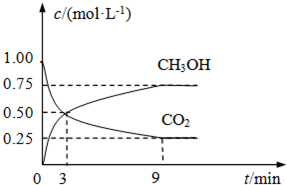
①从3min到9min,v(H2)=
②能说明上述反应达到平衡状态的是
A.反应中CO2与CH3OH的物质的量浓度之比为1:1(即图中交叉点)
B.混合气体的密度不随时间的变化而变化
C.单位时间内消耗3mol H2,同时生成1mol H2O
D.CO2的体积分数在混合气体中保持不变
(3)工业上,CH3OH也可由CO和H2合成.参考合成反应CO(g)+2H2(g)?CH3OH(g)的平衡常数:
下列说法正确的是
A.该反应正反应是放热反应
B.该反应在低温下不能自发进行,高温下可自发进行,说明该反应△S<0
C.在T℃时,1L密闭容器中,投入0.1mol CO和0.2mol H2,达到平衡时,CO转化率为50%,则此时的平衡常数为100
D.工业上采用稍高的压强(5Mpa)和250℃,是因为此条件下,原料气转化率最高.
查看习题详情和答案>>
(1)有效“减碳”的手段之一是节能,下列制氢方法最节能的是
C
C
A.电解水制氢:2H2O
| ||
B.高温使水分解制氢:2H2O
| ||
C.太阳光催化分解水制氢:2H2O
| ||
| 太阳光 |
D.天然气制氢:CH4+H2O
| 高温 |
(2)CO2可转化成有机物实现碳循环.在体积为1L的密闭容器中,充入1mol CO2和3mol H2,一定条件下反应:
CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ?mol-1,测得CO2和CH3OH(g)的浓度随时间变化如图所示.

①从3min到9min,v(H2)=
0.125
0.125
mol?L-1?min-1.②能说明上述反应达到平衡状态的是
D
D
(填编号).A.反应中CO2与CH3OH的物质的量浓度之比为1:1(即图中交叉点)
B.混合气体的密度不随时间的变化而变化
C.单位时间内消耗3mol H2,同时生成1mol H2O
D.CO2的体积分数在混合气体中保持不变
(3)工业上,CH3OH也可由CO和H2合成.参考合成反应CO(g)+2H2(g)?CH3OH(g)的平衡常数:
| 温度/℃ | 0 | 100 | 200 | 300 | 400 |
| 平衡常数 | 667 | 13 | 1.9×10-2 | 2.4×10-4 | 1×10-5 |
AC
AC
.A.该反应正反应是放热反应
B.该反应在低温下不能自发进行,高温下可自发进行,说明该反应△S<0
C.在T℃时,1L密闭容器中,投入0.1mol CO和0.2mol H2,达到平衡时,CO转化率为50%,则此时的平衡常数为100
D.工业上采用稍高的压强(5Mpa)和250℃,是因为此条件下,原料气转化率最高.
(2012?崇明县二模)硫化钠是用于皮革鞣制的重要化学试剂,可用无水芒硝(Na2SO4)与炭粉在高温下反应而制得,反应式如下:
①Na2SO4+4C
Na2S+4CO↑
②Na2SO4+4CO
Na2S+4CO2
(1)现要制取Na2S 7.80g,若生产过程中无水芒硝(Na2SO4)的利用率为90%,则理论上需要无水芒硝(Na2SO4)
(2)若在反应中生成的Na2S物质的量为1mol,则消耗的碳单质的物质的量n的范围是
(3)若在上述反应中消耗的碳单质为1mol,生成Na2S的物质的量为 y mol,生成的CO和CO2的物质的量之比为x,则y与x的关系式为y=
;
(4)Na2S放置在空气中,会缓慢氧化成Na2SO3及Na2SO4,现称取已经部分氧化的硫化钠样品39.20g溶于水中,加入足量硫酸,充分反应后,过滤得沉淀9.6g,放出H2S气体1.12L(标准状况).请计算:39.20g样品中各成分的物质的量分别为
(请写出计算过程)
查看习题详情和答案>>
①Na2SO4+4C
| 高温 |
②Na2SO4+4CO
| 高温 |
(1)现要制取Na2S 7.80g,若生产过程中无水芒硝(Na2SO4)的利用率为90%,则理论上需要无水芒硝(Na2SO4)
15.78
15.78
g(精确到0.01);(2)若在反应中生成的Na2S物质的量为1mol,则消耗的碳单质的物质的量n的范围是
2mol
2mol
<n<4mol
4mol
;(3)若在上述反应中消耗的碳单质为1mol,生成Na2S的物质的量为 y mol,生成的CO和CO2的物质的量之比为x,则y与x的关系式为y=
| x+2 |
| 4+4x |
| x+2 |
| 4+4x |
(4)Na2S放置在空气中,会缓慢氧化成Na2SO3及Na2SO4,现称取已经部分氧化的硫化钠样品39.20g溶于水中,加入足量硫酸,充分反应后,过滤得沉淀9.6g,放出H2S气体1.12L(标准状况).请计算:39.20g样品中各成分的物质的量分别为
2Na2S+Na2SO3+3 H2SO4→3 Na2SO4+3S↓+3H2O,Na2S+H2SO4→Na2SO4+H2S根据以上两个反应结合题中条件可求得:39.20 g样品中有n(Na2S)=0.250 mol、n(Na2SO3)=0.10 mol,再应用质量守恒得n(Na2SO4)=0.05 mol
2Na2S+Na2SO3+3 H2SO4→3 Na2SO4+3S↓+3H2O,Na2S+H2SO4→Na2SO4+H2S根据以上两个反应结合题中条件可求得:39.20 g样品中有n(Na2S)=0.250 mol、n(Na2SO3)=0.10 mol,再应用质量守恒得n(Na2SO4)=0.05 mol
.(请写出计算过程)
A、B、C、D四种气体都含有氮元素.已知A能在高温高压及催化剂作用下生成B;B的水溶液是一种弱碱,B经过铂金属的催化氧化得到C;C是双原子氧化物,在空气中继续氧化得到D;D是硝酸工业尾气中有害物质之一,能与水反应生成C和一元强酸E.按要求填空(1)写出下列反应的化学方程式:
①A→B:
②A→C:
③C→D:
④D通入水中:
(2)写出强酸E与铜片反应分别生成C或D的离子方程式:
①
②
(3)B能被Cl2氧化生成A和一种铵盐,写出反应化学方程式:
查看习题详情和答案>>
①A→B:
N2+3H2
2NH3
| ||
| 高温高压 |
N2+3H2
2NH3
.
| ||
| 高温高压 |
②A→C:
N2+O2
2NO
| ||
N2+O2
2NO
.
| ||
③C→D:
2NO+O2=2NO2
2NO+O2=2NO2
.④D通入水中:
3NO2+H2O=2HNO3+NO
3NO2+H2O=2HNO3+NO
.(2)写出强酸E与铜片反应分别生成C或D的离子方程式:
①
33Cu+2NO3-+8H+=Cu2++2NO↑+4H2O
33Cu+2NO3-+8H+=Cu2++2NO↑+4H2O
;②
Cu+2NO3-+4H+=Cu2++2NO2↑+2H2O
Cu+2NO3-+4H+=Cu2++2NO2↑+2H2O
.(3)B能被Cl2氧化生成A和一种铵盐,写出反应化学方程式:
8NH3+3Cl2=N2+6NH4Cl
8NH3+3Cl2=N2+6NH4Cl
.