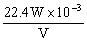3.(1)在析出NaHCO3晶体的同时会析出少量NaCl、NH4CI、NH4HCO3等少量杂质,加热时NH4CI、N4HCO3不稳定已分解逸出。 (2)干燥CO2
(3)(10分)
|
甲 |
84.8% |
失败 |
装置A内等会残留许多CO2,不能充分被C中吸收而偏低 |
|
乙 |
95.4% |
成功 |
|
3.工业制纯碱,是向饱和食盐水中通入氨气和二氧化碳,获得碳酸氢钠晶体,它的反应原理可用下列方程式表示:
NH3+CO2+H2O=NH4HCO3 ①
NH4HCO3+NaC1(饱和)=NaHCO3↓+NH4Cl ②
将所得碳酸氢钠晶体加热分解即可得到纯碱。请回答:
(1)工业所制纯碱中常含少量的氯化钠杂质,其原因是___________
(2)下列装置图中B内浓硫酸的作用是____________
(3)现有甲、乙二个小组的学生,欲测定某工业纯碱样品中Na2CO3的质量分数,分别设计
并完成实验如下:
甲组:取10.00g样品,利用上图所示装置,测出反应后装置C中碱石灰的增重为3.52g
乙组:取10.00g样品,配成1000ml溶液,用碱式滴定管量取25.00ml放入锥形瓶中,加入甲基橙作指示剂,用0.150mol·L-1的标准盐酸溶液滴定至终点(有关反应为Na2CO3+2HCI=2NaCI+H2O+CO2↑)。完成三次平行实验后,消耗盐酸体积的平均值为30.00ml。
请分析计算后填表:
|
|
样品中Na2CO3的质量分数 |
对实验结果的评价(成功或失败) |
实验失败的主要原因以及对实验结果的影响 |
|
甲 组 |
|
|
|
|
乙 组 |
|
|
|
 方法一:用不含Fe3+的FeSO4溶液与用不含O2的蒸馏水配制的NaOH
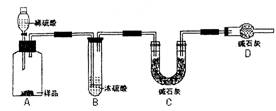
方法一:用不含Fe3+的FeSO4溶液与用不含O2的蒸馏水配制的NaOH +H2O②气体液化温度:NO2 21℃ NO -152℃
+H2O②气体液化温度:NO2 21℃ NO -152℃ 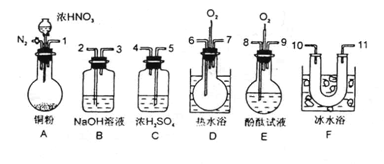
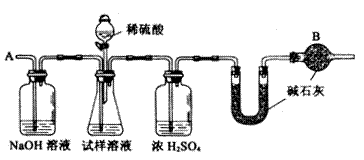 已知某纯碱试样中含有NaCl杂质,为测定试样中纯碱的质量分数,可用下图中的装置进行实验。
已知某纯碱试样中含有NaCl杂质,为测定试样中纯碱的质量分数,可用下图中的装置进行实验。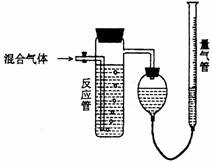 (1)混合气体进入反应管后,量气管内增加的水
(1)混合气体进入反应管后,量气管内增加的水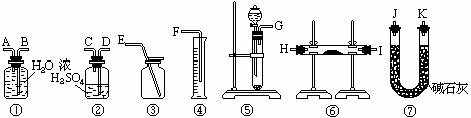 现有一定量含有Na2O杂质的Na2O2试样.请从下图中选用适当的实验装置,设计一个最简单的实验,测定Na2O2试样的纯度(可供选用的反应物只有CaCO3固体,6摩尔/升盐酸和蒸馏水).。请填写下列空白:
现有一定量含有Na2O杂质的Na2O2试样.请从下图中选用适当的实验装置,设计一个最简单的实验,测定Na2O2试样的纯度(可供选用的反应物只有CaCO3固体,6摩尔/升盐酸和蒸馏水).。请填写下列空白: