29.(15) 硫酸亚铁(FeSO4·7H2O)是一种重要的食品和饲料添加剂。实验室通过下列实验由废铁屑制备FeSO4·7H2O晶体:
①将5%Na2CO3溶液加入到盛有一定量废铁屑的烧杯中,加热数分钟,用倾析法除去Na2CO3溶液,然后将废铁屑用水洗涤2-3遍;
②向洗涤过的废铁屑加入过量的稀硫酸,控制温度50-80℃之间至铁屑耗尽;
③趁热过滤,将滤液转入到密闭容器中,静置、冷却结晶;
④待结晶完毕后,滤出晶体,用少量冰水洗涤2-3次,再用滤纸将晶体吸干;
⑤将制得的FeSO4·7H2O晶体放在一个小广口瓶中,密闭保存。
请回答下列问题:
(1)实验步骤①的目的是_________ _____,加热的作用是____________________。
(2)实验步骤②明显不合理,理由是____________ ___________。
(3)实验步骤④中用少量冰水洗涤晶体,其目的是_______ ______;___ ____________。
(4)经查阅资料后发现,硫酸亚铁在不同温度下结晶可分别得到FeSO4·7H2O、FeSO4·4H2O和FeSO4·H2O。硫酸亚铁在不同温度下的溶解度和该温度下析出晶体的组成如下表所示(仅在56.7℃、64℃温度下可同时析出两种晶体)。
|
温度/℃ |
0 |
10 |
30 |
50 |
56.7 |
60 |
64 |
70 |
80 |
90 |
||
|
溶解度/g |
14.0 |
17.0 |
25.0 |
33.0 |
35.2 |
35.3 |
35.6 |
33.0 |
30.5 |
27.0 |
||
|
析出晶体 |
FeSO4·7H2O |
FeSO4·4H2O |
FeSO4·H2O |
|||||||||
请根据表中数据作出硫酸亚铁的溶解度曲线。
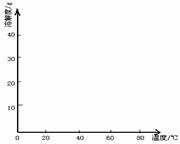
⑤若从硫酸亚铁溶液中结晶出FeSO4·4H2O晶体,应控制的结晶温度(t)的范围为________。
26.(12分)
(1)在上面元素周期表中画出金属元素与非金属元素的分界线。
(2)有人认为形成化合物最多的元素不是IVA族的碳元素,而是另一种短周期元素,请你根据学过的化学知识判断这一元素是 。
(3)现有甲、乙两种短周期元素,室温下,甲元素单质在冷的浓硫酸或空气中,表面都生成致密的氧化膜,乙元素原子核外M电子层与K电子层上的电子数相等。
①用元素符号将甲、乙两元素填写在上面元素周期表中对应的位置。
②甲、乙两元素相比较,金属性较强的是 (填名称),可以验证该结论的实是 。
(a) 将在空气中放置已久的这两种元素的块状单质分别放入热水中
(b) 将这两种元素的单质粉末分别和同浓度的盐酸反应
(c) 将这两种元素的单质粉末分别和热水作用,并滴入酚酞溶液
(d) 比较这两种元素的气态氢化物的稳定性
27(18分)Ⅰ. 通常人们把拆开1 mol某化学键所吸收的能量看成该化学键的键能。键能的大小可以衡量化学键的强弱,也可以估算化学反应的反应热(△H),化学反应的△H等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差。
|
化学键 |
Si-O |
Si-Cl |
H-H |
H-Cl |
Si-Si |
Si-C |
|
键能/kJ·mol-1 |
460 |
360 |
436 |
431 |
176 |
347 |
请回答下列问题:
 (1)比较下列两组物质的熔点高低(填“>”或“<”)
(1)比较下列两组物质的熔点高低(填“>”或“<”)
SiC______Si;SiCL4_________SiO2
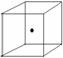
(2)右图立方体中心的“●”表示硅晶体中的一个原子,请在立方体的顶点用“●”表示出与之紧邻的硅原子。
(3)工业上用高纯硅可通过下列反应制取:SiCl4(g)+2H2(g) Si(s)+4HCl(g)
Si(s)+4HCl(g)
该反应的反应热△H=_____________kJ/mol
Ⅱ.右图中,A、C是工业上用途很广的两种重要化工原料,B为日常生活中常见的金属,H、G是正四面体结构的非极性分子,H是一种重要的能源,J是一种耐高温材料,K是由两种常见元素组成的化 合物(图中部分反应物或生成物没有列出)
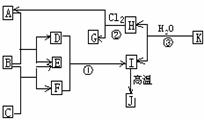
请按要求回答:
(1)写出B的化学式_ __,G的电子式___ ___。
(2)反应①的离子方程式为_______________ _ ____。
(3)反应②进行的条件是______________、_____ _______。
(4)反应③的化学方程式为____________________ ________________。
28 (15分)科学家发现某药物M能治疗心血管疾病是因为它在人体内能释放出一种“信使分子”D,并阐明了D在人体内的作用原理。为此他们荣获了1998年诺贝尔生理学或医学奖。请回答下列问题:
(1)已知M的分子量为227,由C、H、O、N周四种元素组成,C、H、N的质量分数依次为15.86%、2.20%和18.50%。则M的分子式是_____________________。D是双原子分子,分子量为30,则D的分子式为________________。
(2)油脂A经下列途径可得到M。

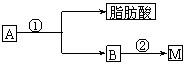 图中②的提示:
图中②的提示:
C2H5OH+HO-NO2 C2H5O-NO2+H2O
硝酸 硝酸乙酯
反应①的化学方程式是
___________________________________________________________________。
反应②的化学方程式是
_________________________________________________________________。
(3)C是B和乙酸在一定条件下反应生成的化合物,分子量为134,写出C所有可能的结构简式_________________________________________。
(4)若将0.1mol B与足量的金属钠反应,则需消耗_________g金属钠。
11. 有编号为1、2、3、4的四瓶无色液体,仅知道是苯、甲苯、氯苯和二甲苯中的分别一种,现在要求甲、乙、丙、丁四位同学进行鉴别,而且每人只鉴别两瓶,告诉学生两瓶鉴别都正确得满分,只有一瓶正确的可以及格。四位同学的结果如下:
|
甲 |
1号为甲苯 |
4号为二甲苯 |
老师评价:四位同学都及格,但是没有一个满分。 |
|
乙 |
1号为氯苯 |
3号为甲苯 |
|
|
丙 |
1号为苯 |
2号为甲苯 |
|
|
丁 |
4号为甲苯 |
2号为氯苯 |
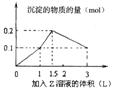 根据实验结果及老师的评价,以下对四瓶无色液体的成分判断正确的是( )
根据实验结果及老师的评价,以下对四瓶无色液体的成分判断正确的是( )
A.1号是苯 B.2号是二甲苯 C.3号是氯苯 D.4号是甲苯
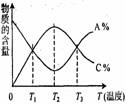 已知可逆反应aA+bB
已知可逆反应aA+bB cC中,物质的含量A%和C%随温度的变化曲线如图所示,下列说法正确的是( )
cC中,物质的含量A%和C%随温度的变化曲线如图所示,下列说法正确的是( )