8. 利用右图装置测定中和热的实验步骤如下:
①
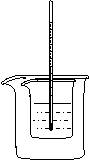
|
 杯中,
测出硫酸
杯中,
测出硫酸
温度为25.0℃
②
 用另一量筒量取50mL 0.55mol·L-1 NaOH
用另一量筒量取50mL 0.55mol·L-1 NaOH
|
|
计测出其温度为25.2℃
③
 将NaOH溶液倒入小烧杯中,设法使之混合均匀,测得混合液
将NaOH溶液倒入小烧杯中,设法使之混合均匀,测得混合液
最高温度为28.5℃。
回答下列问题:
(1)为什么所用NaOH溶液要稍过量?
(2)倒入NaOH溶液的正确操作是 : (从下列选出)
A.沿玻璃棒缓慢倒入 B. 分三次少量倒入 C. 一次迅速倒入
(3)使硫酸与NaOH溶液混合均匀的正确操作是 (从下列选出)
A.用温度计小心搅拌 B.揭开硬纸片用玻璃棒搅拌
C. 轻轻地振荡烧杯 D. 用套在温度计上的环形玻璃棒轻轻的搅动
(4)设溶液的的密度均为1g·cm-3,中和后溶液的比热容 C=4.18J·(g·℃)-1,则该反应中和热的实验值为___________________,中和反应热化学方程式是 ________________________;
(5) 上述实验中中和热的实验值往往小于理论值,其主要原因是(设操作无误)
请提出改进措施
(1)确保硫酸被完全中和 (2)C (3)D
(4)56.8KJ·mol-1(热化学方程式略)
(5)碎纸条的保温性能欠佳。用棉花(或其它保温性能良好的材料)代替碎纸条,或用真空玻璃瓶代替烧杯。
 2CH3CHO+H2O (2分)
2CH3CHO+H2O (2分) 
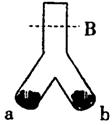 如图,在倒Y型管中可完成很多实验,
如图,在倒Y型管中可完成很多实验,
 将固体溶于水
白色沉淀
沉淀部分溶解→专证明原固体物质含有Na2SO4.
将固体溶于水
白色沉淀
沉淀部分溶解→专证明原固体物质含有Na2SO4.