网址:http://m.1010jiajiao.com/timu3_id_37286[举报]
环境监测测定水中溶解氧的方法是①量取a mL水样迅速加入固定剂MnSO4溶液和碱性KI溶液(含KOH)塞好盖子,摇匀,使之完全反应;②测定:开塞后加适量H2SO4,使之生成I2,再用6 mol/L的Na2S2O3溶液和I2恰好完全反应,消耗3 V mL Na2S2O3溶液,有关方程式为:2Mn2++ O2 + 4OH-= 2MnO(OH)2(快)
MnO(OH)2 + 2I-+ 4H+= Mn2++ I2 +3H2O
I2 + 2Na2S2O3 = 2NaI + Na2S4O6
求:水中溶解氧的量(g/L为单位)( )
A.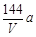 B.
B.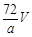 C.
C.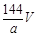 D.
D.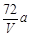
查看习题详情和答案>>
【化学——选修2:化学与技术】(15分)
自来水生产的流程示意图见下:
(1)混凝剂除去悬浮物质的过程 (填写序号)
①只是物理变化 ②只是化学变化 ③是物理和化学变化
FeSO4·7H2O是常用的混凝剂,它在水中最终生成 沉淀。
(2)若要除去Ca2+、Mg2+可以往水中加入石灰和纯碱,试剂填加时先加 后加 ,原因是 。
(3)氯气消毒,是因为它与水反应生成了HClO,次氯酸的强氧化性能杀死水中的病菌(不能直接用次氯酸为自来水消毒是因为次氯酸易分解,且毒性较大)。
Cl2+H2O HCl+HClO K=4.5×10-4
使用氯气为自来水消毒可以有效地控制次氯酸的浓度,请结合平衡常数解释原因:
。
下列物质中, 可以作为氯气的代用品(填写序号)。
① 臭氧 ②NH3(液) ③K2FeO4 ④SO2
(4)有些地区的天然水中含有较多的钙、镁离子。用离子交换树脂软化硬水时,先后把水通过分别装有 离子交换树脂和 离子交换树脂的离子交换柱(填“阴”或“阳”,阳离子交换树脂为HR型,阴离子交换树脂为R'OH型)。
(5)测定水中的溶解氧:量取40mL水样,迅速加入MnSO4和KOH混合溶液,再加入KI溶液,立即塞好塞子,振荡使完全反应。打开塞子,迅速加入适量硫酸溶液,此时有碘单质生成。用0.010mol/LNa2S2O3溶液滴定生成的碘,消耗了6.00mL Na2S2O3溶液。已知在碱性溶液中,氧气能迅速氧化Mn2+,生成物在酸性条件下可以将碘离子氧化为碘单质,本身重新还原为Mn2+。
上述过程发生的反应可表示为:2Mn2++4OH-+O2=2MnO(OH)2
MnO(OH)2+2I-+4H+=I2+Mn2++3H2O I2+2S2O32- =2I-+S4O62-
则水中的溶解氧量为 mg·L-1。
查看习题详情和答案>>
自来水生产的流程示意图见下:
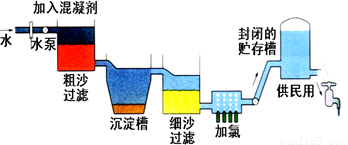
⑴ 混凝剂除去悬浮物质的过程 (填写序号)
①只是物理变化 ②只是化学变化 ③是物理和化学变化
FeSO4·7H2O是常用的混凝剂,它在水中最终生成 沉淀。
⑵ 实验室过滤操作所用到的玻璃仪器是 。
⑶ 我们有时感觉自来水“有漂白粉气味”是因为使用了氯气消毒,请写出有关的化学反应方程式 。
下列物质中, 可以作为氯气的代用品。(填写序号)
① 臭氧 ②NH3(液) ③K2FeO4 ④SO2
⑷ 有些地区的天然水中含有较多的钙、镁离子。用离子交换树脂软化硬水时,先后把水通过分别装有 离子交换树脂和 离子交换树脂的离子交换柱。(填“阴”或“阳”)
⑸ 测定水中的溶解氧:量取20mL水样,迅速加入MnSO4和KOH混合溶液,再加入KI溶液,立即塞好塞子,振荡使完全反应。打开塞子,迅速加入适量硫酸溶液,此时有碘单质生成。用0.10mol/LNa2S2O3溶液滴定生成的碘,消耗了6.00mL Na2S2O3溶液。已知在碱性溶液中,氧气能迅速氧化Mn2+,生成物在酸性条件下可以将碘离子氧化为碘单质,本身重新还原为Mn2+。
上述过程发生的反应可表示为:2Mn2++4OH-+O2=2MnO(OH)2
MnO(OH)2+2I-+4H+=I2+Mn2++3H2O I2+2S2O32-=2I-+S4O62-
求水中的溶解氧量(以mg·g-1为单位)
查看习题详情和答案>>
自来水生产的流程示意图见下:
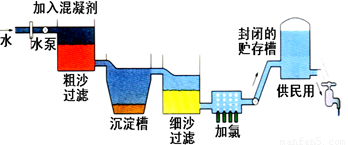
(1)混凝剂除去悬浮物质的过程 (填写序号)
①只是物理变化 ②只是化学变化 ③是物理和化学变化
FeSO4·7H2O是常用的混凝剂,它在水中最终生成 沉淀。
(2)实验室过滤操作所用到的玻璃仪器是 。
(3)我们有时感觉自来水“有漂白粉气味”是因为使用了氯气消毒,请写出有关的化学反应方程式 。
下列物质中, 可以作为氯气的代用品。(填写序号)
① 臭氧 ②NH3(液) ③K2FeO4 ④SO2
(4)有些地区的天然水中含有较多的钙、镁离子。用离子交换树脂软化硬水时,先后把水通过分别装有离子交换树脂和 离子交换树脂的离子交换柱。(填“阴”或“阳”)
(5)测定水中的溶解氧:量取20mL水样,迅速加入MnSO4和KOH混合溶液,再加入KI溶液,立即塞好塞子,振荡使完全反应。打开塞子,迅速加入适量硫酸溶液,此时有碘单质生成。用0.10mol/LNa2S2O3溶液滴定生成的碘,消耗了6.00mL Na2S2O3溶液。已知在碱性溶液中,氧气能迅速氧化Mn2+,生成物在酸性条件下可以将碘离子氧化为碘单质,本身重新还原为Mn2+。
上述过程发生的反应可表示为:2Mn2++4OH-+O2=2MnO(OH)2
MnO(OH)2+2I-+4H+=I2+Mn2++3H2O I2+2S2O32-=2I-+S4O62-
求水中的溶解氧量(以mg·g-1为单位)
查看习题详情和答案>>
【化学——选修2:化学与技术】(15分)
自来水生产的流程示意图见下:

(1)混凝剂除去悬浮物质的过程 (填写序号)
①只是物理变化 ②只是化学变化 ③是物理和化学变化
FeSO4·7H2O是常用的混凝剂,它在水中最终生成 沉淀。
(2)若要除去Ca2+、Mg2+可以往水中加入石灰和纯碱,试剂填加时先加 后加 ,原因是 。
(3)氯气消毒,是因为它与水反应生成了HClO,次氯酸的强氧化性能杀死水中的病菌(不能直接用次氯酸为自来水消毒是因为次氯酸易分解,且毒性较大)。
Cl2+H2O  HCl+HClO
K=4.5×10-4
HCl+HClO
K=4.5×10-4
使用氯气为自来水消毒可以有效地控制次氯酸的浓度,请结合平衡常数解释原因:
。
下列物质中, 可以作为氯气的代用品(填写序号)。
① 臭氧 ②NH3(液) ③K2FeO4 ④SO2
(4)有些地区的天然水中含有较多的钙、镁离子。用离子交换树脂软化硬水时,先后把水通过分别装有 离子交换树脂和 离子交换树脂的离子交换柱(填“阴”或“阳”,阳离子交换树脂为HR型,阴离子交换树脂为R'OH型)。
(5)测定水中的溶解氧:量取40mL水样,迅速加入MnSO4和KOH混合溶液,再加入KI溶液,立即塞好塞子,振荡使完全反应。打开塞子,迅速加入适量硫酸溶液,此时有碘单质生成。用0.010mol/LNa2S2O3溶液滴定生成的碘,消耗了6.00mL Na2S2O3溶液。已知在碱性溶液中,氧气能迅速氧化Mn2+,生成物在酸性条件下可以将碘离子氧化为碘单质,本身重新还原为Mn2+。
上述过程发生的反应可表示为:2Mn2++4OH-+O2=2MnO(OH)2
MnO(OH)2+2I-+4H+=I2+Mn2++3H2O I2+2S2O32- =2I-+S4O62-
则水中的溶解氧量为 mg·L-1。
查看习题详情和答案>>