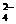15.
蓄电池是一种直流电源,它的用途很广。已知蓄电池在放电时是起原电池作用,在充电
时是起电解作用。其中铅蓄电池是最常用的蓄电池之一,它的两极材料是Pb和PbO2,
电解质是稀H2SO4,放电时电极反应为:Pb - 2e + SO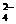 = PbSO4↓
= PbSO4↓
PbO2 + 2e + 4H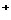 + SO
+ SO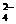 = PbSO4↓+ 2H2O
= PbSO4↓+ 2H2O
铅蓄电池充电时,PbO2极上的电极反应是( )
(A) PbSO4
+ 2e = Pb + SO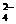
(B) PbO2
+ 2e + 4H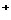 + SO
+ SO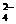 = PbSO4↓+ 2H2O
= PbSO4↓+ 2H2O
(C) Pb - 2e + SO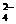 = PbSO4 ↓
= PbSO4 ↓
(D) PbSO4
+ 2H2O - 2e = PbO2 + 4H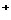 + SO
+ SO