网址:http://m.1010jiajiao.com/timu3_id_350164[举报]
 (I)多项选择题
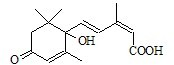
(I)多项选择题北京奥运会期间对大量盆栽鲜花施用了S-诱抗素制剂,以保证鲜花盛开.S-诱抗素的分子结构如图,下列关于该物质的说法正确的是
A.该物质能使鲜花长期盛开
B.1mol该物质与NaOH溶液反应,最多消耗1mol NaOH
C.该物质既能发生加聚反应,又能发生缩聚反应
D.该物质既可以与FeCl3溶液发生显色反应,又可以使酸性KMnO4溶液褪色
E.该物质分子式为C15H20O4
(II)
已知下列信息:
(CH3)2C=CHCH3
| KMnO4 |
| H+ |
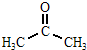 +CH3COOH
+CH3COOHCH2=CH-CH=CH2+CH≡CH
| 120℃ |
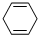
一种用途较广泛的有机玻璃树脂--聚丁烯酸甲酯结构简式为:
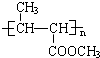
有一种合成这种高聚物的途径副产物污染少或无污染,原子利用率较高,符合“绿色化学挑战计划”的要求,其合成路线如图:
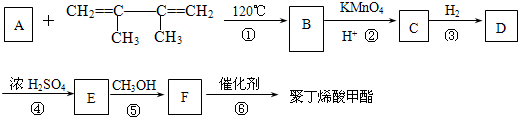
试回答下列问题:
(1)写出B、C所代表的有机物的结构简式B:




(2)
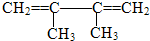 的系统命名名称是
的系统命名名称是(3)B的核磁共振氢谱图上有在
(4)写出下列反应方程式:反应④:




(5)反应物完全转化为产品使原子利用率达到100%是“绿色化学”理念的重要体现.在上述合成过程中符合“绿色化学”理念的化学反应有
A.(1)K3[Fe(CN)6]铁氰化钾又叫赤血盐.是深红色斜方晶体,易溶于水,无特殊气味,能溶于水、丙酮,不溶于乙醇.
①分子内不含有
A.离子键 B.极性键 C.金属键D.配位键 E.氢键 F.非极性键
②中心离子的基态电子排布式
③配位体CN-的等电子体有
④用价电子对互斥理论可知二氧化硒分子的空间构型为
(2)多元化合物薄膜太阳能电池材料为无机盐,其主要包括砷化镓、硫化镉、硫化锌及铜锢硒薄膜电池等.
①第一电离能:As
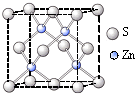
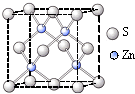
②硫化锌的晶胞中(结构如右图所示),硫离子的配位数是
B.某化学研究性学习小组为探究某品牌花生油中不饱和脂肪酸的含量,进行了如下实验:
步骤I:称取0.4g花生油样品,置于两个干燥的碘瓶(如图)内,加入10mL四氯化碳,轻轻摇动使油全部溶解.向碘瓶中加入25.00mL含0.01mol IBr的无水乙酸溶液,盖好瓶塞,在玻璃塞与瓶口之间滴加数滴10%碘化钾溶液封闭缝隙,以免IBr的挥发损失.
步骤II:在暗处放置30min,并不时轻轻摇动.30min后,小心地打开玻璃塞,用新配制的10%碘化钾10mL和蒸馏水50mL把玻璃塞和瓶颈上的液体冲洗入瓶内.
步骤Ⅲ:加入指示剂,用0.1mol?L-1硫代硫酸钠溶液滴定,用力振荡碘瓶,直至终点.
测定过程中发生的相关反应如下:
①
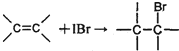
②IBr+KI=I2+KBr
③I2+2S2O32-=2I-+S4O62-
请回答下列问题:
(1)已知卤素互化物IBr的性质与卤素单质类似,实验中准确量取IBr溶液应选用的仪器是
(2)步骤Ⅱ中碘瓶在暗处放置30min,并不时轻轻摇动的原因是
(3)步骤Ⅲ中所加指示剂为
A.(1)K3[Fe(CN)6]铁氰化钾又叫赤血盐.是深红色斜方晶体,易溶于水,无特殊气味,能溶于水、丙酮,不溶于乙醇.
①分子内不含有______(填序号).
A.离子键 B.极性键 C.金属键D.配位键 E.氢键 F.非极性键
②中心离子的基态电子排布式______.
③配位体CN-的等电子体有______(写出两种).
④用价电子对互斥理论可知二氧化硒分子的空间构型为______.
(2)多元化合物薄膜太阳能电池材料为无机盐,其主要包括砷化镓、硫化镉、硫化锌及铜锢硒薄膜电池等.
①第一电离能:As______Se(填“>”、“<”或“=”).
②硫化锌的晶胞中(结构如右图所示),硫离子的配位数是______.
B.某化学研究性学习小组为探究某品牌花生油中不饱和脂肪酸的含量,进行了如下实验:
步骤I:称取0.4g花生油样品,置于两个干燥的碘瓶(如图)内,加入10mL四氯化碳,轻轻摇动使油全部溶解.向碘瓶中加入25.00mL含0.01mol IBr的无水乙酸溶液,盖好瓶塞,在玻璃塞与瓶口之间滴加数滴10%碘化钾溶液封闭缝隙,以免IBr的挥发损失.
步骤II:在暗处放置30min,并不时轻轻摇动.30min后,小心地打开玻璃塞,用新配制的10%碘化钾10mL和蒸馏水50mL把玻璃塞和瓶颈上的液体冲洗入瓶内.
步骤Ⅲ:加入指示剂,用0.1mol?L-1硫代硫酸钠溶液滴定,用力振荡碘瓶,直至终点.
测定过程中发生的相关反应如下:
①
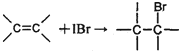
②IBr+KI=I2+KBr
③I2+2S2O32-=2I-+S4O62-
请回答下列问题:
(1)已知卤素互化物IBr的性质与卤素单质类似,实验中准确量取IBr溶液应选用的仪器是______,碘瓶不干燥会发生反应的化学方程式______.
(2)步骤Ⅱ中碘瓶在暗处放置30min,并不时轻轻摇动的原因是______.
(3)步骤Ⅲ中所加指示剂为______,滴定终点的现象______.
本题包括A、B两小题,分别对应于“物质结构与性质”和“实验化学”两
个选修模块的内容。请选择其中一题作答。若两题都做,则按A题评分。
A.微粒A、B、C为分子,D和F为阳离子,E为阴离子,它们都含有lO个电子;B溶
于A后所得的物质可电离出D和E;C是重要的化石能源。将A、B和含F离子的物
质混合后可得D和一种白色沉淀。G3+离子与Ar原子的电子层结构相同。请回答:
(1)基态G原子的外围电子排布式是 。在A、B、C这三种分子中,属于非极
性分子的有 (写化学式)。
(2)下列有关B的说法中正确的是 。(填字母)
a.在配合物中可作为配体 b.该分子的稳定性与氢键有关
c.分子由各原子最外层均为8![]() 。的稳定结构
。的稳定结构
d.含1 mol B的液体中有3 mol氢键
(3)根据等电子体原理,D离子的空间构型是 ,其中心原子轨道的杂化类型
 是 。
是 。
(4)构成C的中心原子可以形成多种单质,其中有一种为空间网状结
构,右图立方体中心的“●”表示该晶体中的一个原子,请在该
立方体的顶点上用“●”表示出与之紧邻的原子。
(5)光谱证实F与烧碱溶液反应有Na[F(OH)4]生成,则Na[F(OH)4]中
不存在 。(填字母)
a.金属键 b.离子键 c.非极性键 d.极性键
f.配位键 g.![]() 键 h.
键 h.![]() 键
键
B.对氨基苯磺酸是制取某些染料和药物的重要中间体,可由苯胺磺化得到:


实验室可用苯胺、浓硫酸为原料,利用右图所示实验装置合成。
实验步骤如下:
①取一个250mL的仪器a,加入10mL苯胺及几粒沸石,
放人冷水中冷却,小心地加入18 mL浓硫酸。再分别
装上冷凝管、温度计等。
②将a置于油浴中缓慢加热至170`180℃,维持此温度约2.5 h。
③将反应产物冷却至约50℃后,倒入盛有100mL,冷水的烧杯中,用玻璃棒不断搅拌,促使晶体析出。用该烧杯中的少量冷水将a内残留的产物冲洗到烧杯中,抽滤,用少量冷水洗涤,得到粗产品。
④将粗产品用沸水溶解,冷却结晶(若溶液颜色过深,可用活性炭脱色),抽滤,收集
产品,晾干。(提示:100mL水在20℃时可溶解对氨基苯磺酸1.08 g,在100℃时可
溶解6.67 g)
(1)仪器a的名称是 。步骤①中加入沸石的作用是 。
(2)步骤②中采用油浴加热,下列说法正确的是 。(填字母)
A.便于控制温度 B.也可以改用水浴加热 C.温度计的水银球也可浸在油中
(3)步骤③用冷水洗涤的优点是 。
(4)步骤③和④均进行了抽滤操作,在抽滤完毕停止抽滤时,应注意先一二,然
后 。
(5)步骤④有时需重复进行多次,其目的是 。
查看习题详情和答案>>A.(1)K3[Fe(CN)6]铁氰化钾又叫赤血盐.是深红色斜方晶体,易溶于水,无特殊气味,能溶于水、丙酮,不溶于乙醇.
①分子内不含有______(填序号).
A.离子键 B.极性键 C.金属键D.配位键 E.氢键 F.非极性键
②中心离子的基态电子排布式______.
③配位体CN-的等电子体有______(写出两种).
④用价电子对互斥理论可知二氧化硒分子的空间构型为______.
(2)多元化合物薄膜太阳能电池材料为无机盐,其主要包括砷化镓、硫化镉、硫化锌及铜锢硒薄膜电池等.
①第一电离能:As______Se(填“>”、“<”或“=”).
②硫化锌的晶胞中(结构如右图所示),硫离子的配位数是______.

B.某化学研究性学习小组为探究某品牌花生油中不饱和脂肪酸的含量,进行了如下实验:
步骤I:称取0.4g花生油样品,置于两个干燥的碘瓶(如图)内,加入10mL四氯化碳,轻轻摇动使油全部溶解.向碘瓶中加入25.00mL含0.01mol IBr的无水乙酸溶液,盖好瓶塞,在玻璃塞与瓶口之间滴加数滴10%碘化钾溶液封闭缝隙,以免IBr的挥发损失.
步骤II:在暗处放置30min,并不时轻轻摇动.30min后,小心地打开玻璃塞,用新配制的10%碘化钾10mL和蒸馏水50mL把玻璃塞和瓶颈上的液体冲洗入瓶内.
步骤Ⅲ:加入指示剂,用0.1mol?L-1硫代硫酸钠溶液滴定,用力振荡碘瓶,直至终点.
测定过程中发生的相关反应如下:

①

②IBr+KI=I2+KBr
③I2+2S2O32-=2I-+S4O62-
请回答下列问题:
(1)已知卤素互化物IBr的性质与卤素单质类似,实验中准确量取IBr溶液应选用的仪器是______,碘瓶不干燥会发生反应的化学方程式______.
(2)步骤Ⅱ中碘瓶在暗处放置30min,并不时轻轻摇动的原因是______.
(3)步骤Ⅲ中所加指示剂为______,滴定终点的现象______.
查看习题详情和答案>>