例1燃料电池是燃料(如H2、CO、CH4等)跟氧气或空气起反应,将化学能转变为电能的装置,电解质溶液是强碱溶液.下面关于甲烷燃料电池的说法中正确的是()
A.负极反应为:O2+2H2+4e=4OH-
B.负极反应为:CH4+10OH--8e=CO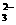 +7H2O
+7H2O
C.随着放电的进行,溶液的pH值不变
D.放电时溶液中的阴离子向负极移动
[解析]无论什么电池(包括可充电电池),在放电时都是负极发生氧化反应失去电子,正极发生还原反应得到电子,燃料电池也不例外.甲烷燃料电池的负极反应是甲烷失电子被氧化,在碱性条件下生成CO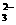 :CH4+10OH--8e=CO
:CH4+10OH--8e=CO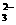 +7H2O;正极反应是O2获得电子:O2+2H2O+4e=4OH-.由电极反应可知,当得失电子相等时,负极消耗的OH-多于正极生成的OH-,因而放电过程中溶液的pH下降,在放电过程中,负极消耗OH-,而正极产生OH-,所以OH-要由正极向负极移动。
+7H2O;正极反应是O2获得电子:O2+2H2O+4e=4OH-.由电极反应可知,当得失电子相等时,负极消耗的OH-多于正极生成的OH-,因而放电过程中溶液的pH下降,在放电过程中,负极消耗OH-,而正极产生OH-,所以OH-要由正极向负极移动。
[答案]B、D
[评注]此题给出的信息是燃料电池的构成--电极是燃料甲烷和空气中的氧气,电解质是强碱溶液,考生只需将原电池的有关知识对应地机械地迁移到燃料电池,就可以解决问题,因此此题是一道典型的机械性信息迁移题.
例2在25℃时,若10体积的某强酸与1体积的某强碱溶液混合后溶液呈中性,则混合之前,该强酸的pH与强碱的pH之间满足的关系是。
[解析]本题考查酸碱中和pH概念及运算等知识点,能力要求高。将具体问题抽象化,考查学生抽象思维能力和文字表达能力。解本题的关键是酸碱混合后溶液呈中性。
解法Ⅰ把10体积强酸溶液加到1体积强碱溶液中,可看作先把强碱溶液稀释10倍后与等体积强酸溶液完全中和,此时强酸溶液的pH减少一个单位为:pH碱-1
因混合后溶液呈中性,故 =14-(pH碱-1)即pH酸+pH碱=15
=14-(pH碱-1)即pH酸+pH碱=15
解法Ⅱ由题中条件可知: =10
=10
即[OH-]碱=10[H+]酸,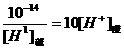
[H+]酸·[H+]碱=10-15?
二边取负对数得pH酸+pH碱=15
[答案]强酸的pH与强碱的pH之和等于15。
例3下列叙述正确的是
A.元素的单质可由氧化或还原含该元素的化合物来制得
B.得电子越多的氧化剂,其氧化性就越强
C.阳离子只能得到电子被还原,只能作氧化剂
D.含有最高价元素的化合物不一定具有强的氧化性
[解析]氧化还原的概念在中学化学中是一个重要知识点也是一个难点。本题考查学生对氧化还原概念的掌握情况,包括氧化、还原、氧化剂、还原剂、被氧化、被还原、氧化性、还原性……等等。元素的单质可以由氧化或还原含该该元素的化合物而制得,这是正确的,如NaCl中的Na+离子就可被还原为Na,而Cl-离子可被氧化制得氯气,选项A正确。得电子越多的氧化剂,其氧化性越强这说法不一定正确,如CuSO4作为氧化剂,Cu2+2e=Cu,每个铜离子得2个电子,而氯气作为氧化剂,Cl2+2e=2Cl-,每个氯原子只得1个电子,实际上氯气的氧化性比Cu2+离子要强得多,选项B不正确。一般情况下在氧化还原反应中阳离子常常是得到电子而被还原可以用作氧化剂;但是某些情况下阳离子也可以进一步失去电子,因此成为还原剂,例如硫酸亚铁中的Fe2+离子遇上较强氧化剂时,Fe2+-e=Fe3+,所以选项C不全面、不正确。含有最高价元素的化合物不一定是具有强氧化性,这种看法是正确的。例如Na3PO4中的磷是+5价的,但Na3PO4几乎没有氧化性,所以选项D也是正确的。[答案]A、D
例4以下叙述正确的是
A.阴、阳离子通过静电引力形成离子键
B.若A B-Q(Q>0),则可判断A比B稳定
B-Q(Q>0),则可判断A比B稳定
C.离子化合物中不可能含共价键
D.石墨晶体中,每个碳原子和周围4个碳原子形成共价键
[解析]阴、阳离子间不仅存在静电引力,还存在着电子之间、原子核之间的静电斥力等,因此不能说通过静电引力而形成离子键,而应将静电引力改为静电作用。对于多种元素原子形成的离子,可以有共价键存在,所以离子化合物中可能含有共价键。在石墨晶体中,同一层的每个碳原子与周围3个碳原子直接相邻形成共价键,而层与层之间是以范德华力相结合,所以A、C、D均是错误的。
物质的稳定性与其所含的能量高低有直接关系。由A转化为B,是吸收能量的反应,所以A物质具有的能量比B物质低,A比B稳定。
[答案]B
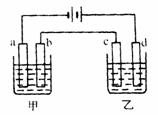
例5如图a、b、c、d均为铂电极,供选择的4组电解质溶液如下表:
|
组 |
A |
B |
C |
D |
|
甲槽 |
NaOH |
AgNO3 |
H2SO4 |
NaCl |
|
乙槽 |
CuSO4 |
CuCl2 |
AgNO3 |
AgNO3 |
要满足的条件是:
①工作一段时间后,甲槽电解液pH上升,而乙槽电解液pH下降;
②b、c两极放电离子的物质的量相等。
则(1)应选用的电解液是组。
(2)甲槽的电解方程式为。
乙槽的电解方程式为。
[解析]本题主要考查电解原理和离子放电顺序等知识点,考查学生逆向思维能力。
根据电解规律,电解后电解液的pH升高的有NaOH和NaCl,pH降低的有CuSO4和AgNO3,pH基本不变的有CuCl2,由条件①排除B、C.又因甲、乙池是串联的,故b为阳极,c为阴极,A、D组电解液的电极反应为:
A组B组
b极:4OH-4e=O2↑+2H2O2Cl--2e=Cl2↑
c极:2Cu2++4e=2Cu2Ag++2e=2Ag
由条件②排除A。
[答案](1)D
(2)甲池:2NaCl+2H2O 2NaOH+H2↑+Cl2↑
2NaOH+H2↑+Cl2↑
乙池:4AgNO3+2H2O 4Ag+4HNO3+O2↑
4Ag+4HNO3+O2↑
例6我国农业因遭受酸雨而造成每年损失高达15亿多元。为了有效控制酸雨,目前国务院已批准了《酸雨控制区和二氧化硫污染控制区划分方案》等法规。
(1)你认为减少酸雨产生的途径可采取的措施是()。
①少用煤作燃料;②把工厂烟囱造高;③燃料脱硫;
④在已酸化的土壤中加石灰;⑤开发新能源
A.①②③B.②③④⑤C.①③⑤D.①③④⑤
(2)在英国进行的一个研究结果表明:高烟囱可以有效地降低地表面SO2浓度。在20世纪的60-70年代的10年间,由发电厂排放出的SO2增加了35%,但由于建造高烟囱的结果,地面浓度降低了30%之多。请你从全球环境保护的角度,分析这种方法是否可取?简述理由。
(3)传统的煤、石油作燃料,其主要缺点是什么?与传统的煤、石油燃料相比,哪种物质可作为新的能源?主要优点又是什么?
答案:(1)C。(2)不可取;因SO2的排放总量没有减少,所进一步形成的酸雨仍会造成对全球的危害。(3)煤、石油是不易再生的化石燃料,其资源是有限的;其次,燃烧后产生的SO2、NO 等严重污染大气,形成酸雨;燃烧后产生的CO2又导致地球表面气温升高(“温室效应”)。
等严重污染大气,形成酸雨;燃烧后产生的CO2又导致地球表面气温升高(“温室效应”)。
H2;第一,H2可以用水作原料来制取,有广泛的来源;其次,H2燃烧时放热多,放出的热量约为同质量的汽油的三倍;第三,氢燃料的最大优点是燃烧的产物的水,不污染环境,还可循环利用。
 B(s)
+C(g)+D(g),若测知生成的气体的质量是同温同压相同体积氢气的10倍,且当所得气体在标准状况下的体积为22.4L时,所得B的质量为30.4g,则A的摩尔质量为( )
B(s)
+C(g)+D(g),若测知生成的气体的质量是同温同压相同体积氢气的10倍,且当所得气体在标准状况下的体积为22.4L时,所得B的质量为30.4g,则A的摩尔质量为( )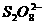 +2e
+2e 、Mn2++4H2O
、Mn2++4H2O MnO-4+8H+5e,推测氧化1.5molMn2+需
MnO-4+8H+5e,推测氧化1.5molMn2+需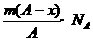 B.
B.
 D.
D.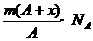
 B.X一定等于
B.X一定等于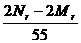
 D.以上全错
D.以上全错 中的3个氢原子都可以跟重水分子(D2O)中的D原子发生氢交换。又次磷酸(H3PO2)也可跟D2O进行氢交换,但次磷酸二氢钠(NaH2PO2)却不能再跟D2O发生氢交换。由此可推断出H3PO2的分子结构是()
中的3个氢原子都可以跟重水分子(D2O)中的D原子发生氢交换。又次磷酸(H3PO2)也可跟D2O进行氢交换,但次磷酸二氢钠(NaH2PO2)却不能再跟D2O发生氢交换。由此可推断出H3PO2的分子结构是() 食盐晶体由钠离子和氯离子组成,这两种离子在空间的三个垂直方向都是等距离地交错排列。已知食盐的密度是2.2g/cm3,则食盐中相邻的钠离子核间的数值最接近于()
食盐晶体由钠离子和氯离子组成,这两种离子在空间的三个垂直方向都是等距离地交错排列。已知食盐的密度是2.2g/cm3,则食盐中相邻的钠离子核间的数值最接近于()
 H2CO3
H2CO3 H++HCO-3。又知人体呼出的气体中CO2体积分数约5%。下列说法正确的是()
H++HCO-3。又知人体呼出的气体中CO2体积分数约5%。下列说法正确的是() Ag2O+SO3(g),2SO3(g)
Ag2O+SO3(g),2SO3(g)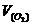 =0.05mol/(L·min)
=0.05mol/(L·min) B.
B.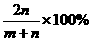
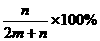 D.
D.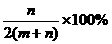
 的酸性工业废水会造成铬污染,排放前先将
的酸性工业废水会造成铬污染,排放前先将
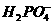 +H2O
+H2O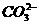 +2H+
+2H+ 、NO
、NO
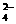
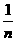 时,其电离度将增大到原溶液电离度的
时,其电离度将增大到原溶液电离度的 倍。现有pH=2的某一元弱酸溶液10mL,加水至1L后,溶液的pH是()
倍。现有pH=2的某一元弱酸溶液10mL,加水至1L后,溶液的pH是()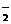 、CO
、CO >H+B.Na+>H2PO
>H+B.Na+>H2PO
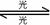 O2+OCl+O3
O2+OCl+O3
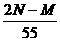 B.一定等于
B.一定等于
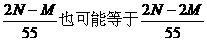 D.以上都不对
D.以上都不对 +H2O,N2H4+H2O
+H2O,N2H4+H2O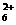 +OH-,N2H
+OH-,N2H