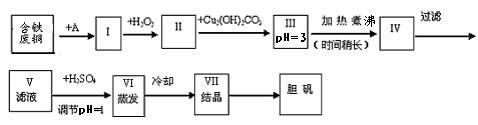
21.(16分)胆矾是一种常见的化合物,工业上它也是一种制取其它含铜化合物的原料。现有废铜(主要杂质为Fe)来制备胆矾。有人设计了如下流程:
 PH值控制可参考下列数据
PH值控制可参考下列数据
|
物
质 |
开始测定时的PH值 |
完全测定时的PH值 |
|
氢氧化铁 |
2.7 |
3.7 |
|
氢氧化亚铁 |
7.6 |
9.6 |
|
氢氧化铜 |
5.2 |
6.4 |
请根据上述流程回答下列问题:
(1) A物质可选用___________填字母。
(a)稀H2SO4 (b) 浓H2SO4 (c)浓FeCl3溶液 (d)浓HNO3
(2) I中加H2O2的目的___________________。
(3) II中加Cu2(OH)2CO3的目的是___________________________其优点是____________。
(4) III加热煮沸时发生的化学反应的离子方程式为__________________。
(5) V中加H2SO4调节PH=1是为了________________________________。
(6) 某工程师认为上述流程中所加的A物质并不理想,需作改进,其理由是__________________________________。若你是该工程师,将对所加的A物质作何改进?请提出建议_____________________________________。
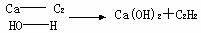
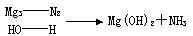
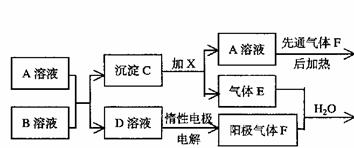 12,已知FeSO3不溶于水但可溶于强酸。下图表示一些常见无机物之间的转化关系:
12,已知FeSO3不溶于水但可溶于强酸。下图表示一些常见无机物之间的转化关系: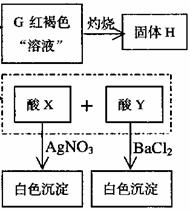
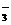 +NO拆写成两个“半反应式”
+NO拆写成两个“半反应式”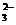 +7H2O,则总反应式为___________________________________________________________。
+7H2O,则总反应式为___________________________________________________________。 10,铅蓄电池放电时起原电池的作用,充电时起电解池的作用,铅蓄电池在放电和充电时发生的化学反应可用下式表示:
10,铅蓄电池放电时起原电池的作用,充电时起电解池的作用,铅蓄电池在放电和充电时发生的化学反应可用下式表示: 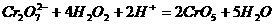
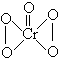
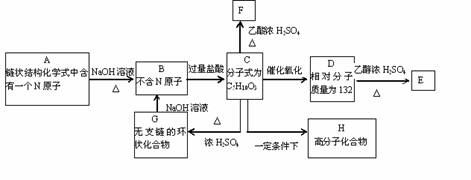
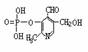 )能有效地促进植物对氮肥的吸收。 试回答:
)能有效地促进植物对氮肥的吸收。 试回答: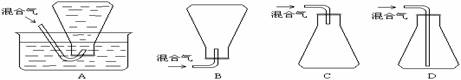 (4)本样品收集时,可选用的方法是____________。
(4)本样品收集时,可选用的方法是____________。