网址:http://m.1010jiajiao.com/timu3_id_350150[举报]
下列关于化工生产的叙述正确的是
A.炼钢就是在高炉中用还原剂把铁从铁矿石中还原出来
B.离子交换膜法制碱工业中,氢氧化钠在电解槽的阴极区产生
C.工业制硫酸中,三氧化硫是在吸收塔内用98%的硫酸吸收
D.黏土是生产陶瓷、玻璃和水泥的共同原料
(Ⅱ)氨是重要的无机化工产品之一,在国民经济中占有重要地位.世界上的氨除少量从焦炉气中回收副产外,绝大部分是合成的氨.海南岛的南海北部湾莺歌海海域有着丰富的天然气气田,利用此资源在东方市八所港建有一家大型的合成氨化肥厂.
(1)写出该化肥厂生产H2的化学反应方程式
(2)在硫酸的工业生产中,往往会增大O2的比例来提高SO2的转化率,在合成氨生产中是否会采用相同的方法,请说明理由.
(3)在制取原料气体的过程中,常混有一些杂质,在进入合成塔之前必须将杂质除去,原因是
(4)下图是氨的产率与温度的关系,曲线1表示平衡时氨的产率,曲线2表示反应进行一段时间但还未达到平衡时氨的含量.请分析A点氨的含量小于B的原因
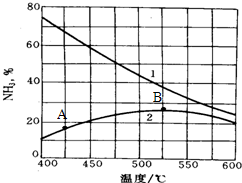
(5)在合成氨的生产过程中会产生大量CO2,该化肥厂与俄罗斯塔氏集团合作,利用这些CO2建设一个年产52万吨的小颗粒尿素加工厂,再进一步加工成氮磷钾复合肥,请写出该合成尿素反应的化学方程式
下列有关化工生产的说法中不正确的是
A.工业上用电解熔融的氯化物的方法制备金属镁和铝
B.适当提高合成氨原料气中N2的含量,可提高H2的转化率
C.从安全运输上看,硫酸厂靠近硫酸消费中心比靠近原料产地更为有利
D.利用反应NaCl(饱和)+CO2+NH3+H2O=NH4Cl+NaHCO3↓制取NaHCO3时,应在NaCl饱和溶液中先通入过量CO2再通入过量的NH3
E.硫酸厂生产时常采有高压条件提高SO2的转化率
(II)
过碳酸钠(2Na2CO3?3H2O2)俗称固体双氧水,被大量用于洗涤、印染、纺织、造纸、医药卫生等领域中.它的制备原理和路线如下:
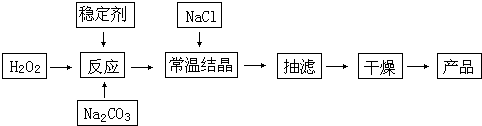
试回答下列问题:
(1)与过碳酸钠的用途相关的化学性质是
A.MnO2 B. H2S C.稀硫酸 D. NaHCO3
(2)加入NaCl的作用是
(3)工业纯碱中含有Fe3+等杂质,加入稳定剂的作用是与生成稳定的配合物.Fe3+的不良影响是
| ||
| ||
(4)反应的最佳温度控制在15~25℃,温度偏高时造成产率偏低的可能原因是
(5)有人想用过碳酸钠测定氢溴酸的浓度.若一定量的过碳酸钠与100mL氢溴酸溶液恰好完全反应,在标准状况下产生448mL气体,则所用氢溴酸的浓度为
 (I)多项选择题
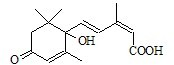
(I)多项选择题北京奥运会期间对大量盆栽鲜花施用了S-诱抗素制剂,以保证鲜花盛开.S-诱抗素的分子结构如图,下列关于该物质的说法正确的是
A.该物质能使鲜花长期盛开
B.1mol该物质与NaOH溶液反应,最多消耗1mol NaOH
C.该物质既能发生加聚反应,又能发生缩聚反应
D.该物质既可以与FeCl3溶液发生显色反应,又可以使酸性KMnO4溶液褪色
E.该物质分子式为C15H20O4
(II)
已知下列信息:
(CH3)2C=CHCH3
| KMnO4 |
| H+ |
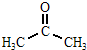 +CH3COOH
+CH3COOHCH2=CH-CH=CH2+CH≡CH
| 120℃ |
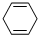
一种用途较广泛的有机玻璃树脂--聚丁烯酸甲酯结构简式为:
有一种合成这种高聚物的途径副产物污染少或无污染,原子利用率较高,符合“绿色化学挑战计划”的要求,其合成路线如图:
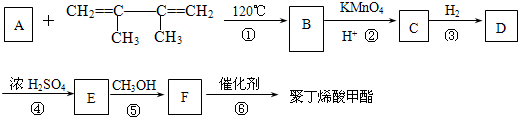
试回答下列问题:
(1)写出B、C所代表的有机物的结构简式B:




(2)
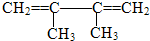 的系统命名名称是
的系统命名名称是(3)B的核磁共振氢谱图上有在
(4)写出下列反应方程式:反应④:




(5)反应物完全转化为产品使原子利用率达到100%是“绿色化学”理念的重要体现.在上述合成过程中符合“绿色化学”理念的化学反应有
下列曲线分别表示元素的某种性质与核电荷数的关系(Z为核电荷数,Y为元素的有关性质).则下列有关Y的意义的叙述正确的是

A.a图表示第三周期元素的原子半径(稀有气体除外)
B.b图表示ⅡA族元素的最外层电子数
C.c图表示第二周期元素的电负性(稀有气体除外)
D.d图表示第三周期元素的第一电离能(稀有气体除外)
E.e图表示第ⅦA族元素氢化物的沸点
(II)
波尔多液是一种保护性杀菌剂,广泛应用于树木、果树和花卉上,鲜蓝色的胆矾晶体是配制波尔多液的主要原料.胆矾CuSO4?5H2O可写成[Cu(H2O)4]SO4?H2O,其结构示意图如下:

(1)写出铜原子价层电子的轨道排布式


(2)由上图可知:胆矾中存在的作用力有
a.离子键 b.配位键 c.氢键 d.极性键 e.非极性键
(3)往浓CuSO4溶液中加入过量较浓的NH3?H2O直到原先生成的沉淀恰好溶解为止,得到深蓝色溶液.小心加入约和溶液等体积的C2H5OH并使之分成两层,静置.经过一段时间后可观察到在两层“交界处”下部析出深蓝色Cu(NH3)4SO4?H2O晶体.实验中所加C2H5OH的作用是
(4)已知Cu(NH3)42+呈平面正方形结构,则Cu(NH3)4SO4?H2O晶体中呈正四面体的粒子是
(5)如将深蓝色溶液加热,可能得到什么结果?
《物质结构与性质》
19-1.(6分,该题为多项选择题,全选对得6分,漏选按比例给分,错选或多选为0分)下列说法正确的是 ( )
A.基态原子中不一定都有未成对的电子
B.由极性键形成的分子一定是极性分子
C.晶格能大小顺序:NaCl > KCl
D.离子晶体中每个阳离子周围均吸引着6个带相反电荷的离子
E.在CaO和SiO2晶体中,都不存在单个小分子
19-2.(14分)四种常见元素的性质或结构信息如下表,试根据信息回答有关问题。
| 元素 | A | B | C | D |
| 性质 结构 信息 | 基态原子核外有两个电子层,最外层有3个未成对的电子 | 基态原子的M层有1对成对的p电子 | 基态原子核外电子排布为[Ar]3d104sx,有+1、+2两种常见化合价 | 有两种常见氧化物,其中有一种是冶金工业常用的还原剂 |
(1)写出B原子的基态电子排布式 。
(2)A元素的氢化物的沸点比同主族相邻元素氢化物沸点 (填“高”或“低”),其原因是 。
(3)D元素最高价氧化物的熔点比同主族相邻元素最高价氧化物的熔点 (填“高”或“低”),其原因是 。
(4)往C元素的硫酸盐溶液中逐滴加入过量A元素的氢化物水溶液,可生成的配合物的化学式为 ,简要描述该配合物中化学键的成键情况 。
(5)下列分子结构图中的“●”表示上述相关元素的原子中除去最外层电子的剩余部分,“ O”表示氢原子,小黑点“ ·”表示没有形成共价键的最外层电子,短线表示共价键。
则在以上分子中,中心原子采用sp3杂化形成化学键的是 (填写序号);在②的分子中有 个σ键和 个π键。
查看习题详情和答案>>