(一)选择(每小题有1-2个正确答案)
1.关于SO2和SO3的叙述,正确的是( )
A.它们在常温下,均可使品红溶液褪色
B.都是酸性氧化物,溶于水都生成稳定的强酸
C.加入盐酸酸化的BaCl2溶液都能生成白色沉淀
D.它们在一条条件下,可以相互转化
2.除去试管壁上附着的硫,可采用的方法是( )
A.通入氢气的加热 B.伸入灼热的铁丝
C.用水洗涤 D.用二硫化碳洗后再用水洗
3.下列叙述中,正确的是( )
A.硫可以做成硫磺软膏,防治皮肤病
B.氯气和二氧化硫均分别可作漂白剂.若同时使用它们去漂白某一湿润的物质,漂白效果将明显增强
C.为实现中国2000年消除碘缺乏症的目标,国家卫生部规定食盐必须加碘,其中碘以单质的形式存在
D.工业酒精不能兑水作饮料酒,因其中含有甲醇,它虽也具酒香气味,但若饮人少量,轻则双目失明,重则死亡
4.下列物质不能用对应元素的单质直接化合制取的是( )
①CuS ②FeS ③Al2S3 ④Fe2S3 ⑤Cu2S ⑥CS1 ⑧H2Se ⑨H2O2 ⑩Fe3O2
A.②⑤⑦⑧ B.①④⑥⑨ C.③④⑦⑩ D.④⑥⑦
5.两份质量为mg的硫,在一定条件下分别与足量的氢气和氧气充分反应。反应后将生成的物质充分混合,析出硫的质量是( )
A.2mg B.mg C.1.5mg D.0.5mg
6.标准状况下,在臭氧发生器中装入100mL氧气,最后的体积变为95mL(标准状况)。则最终状态时混合气体的密度是( )
A.1.3g/L B.1.5g/L C.1.7g/L D.1.9g/L
7.下列有关氧族元素的叙述不正确的是( )
A.随着原子序数递增,单质熔沸点升高 B.都能形成+4和+6价化合物
C.能跟大多数金属直接化合 D.都能跟氢气直接化合生成氢化物
8.高氯酸是最强的酸。60%的高氯酸溶液加热不分解,但浓度再高就不稳定,受热易分解。热浓的高氯酸遇有机物易爆炸。纯高氯酸的沸点是130℃。现在70%的商品高氯酸,为使其进一步浓缩,所采取的正确措施是( )
A.加入浓H2SO4后,再小心常压蒸馏 B.加入浓H2SO4,再进行减压蒸馏
 C.含仪器连接处的橡皮塞应塞紧,防止漏气
C.含仪器连接处的橡皮塞应塞紧,防止漏气
D.各仪器连接处必须用磨口玻璃装置
9.图13-1是一套检验气体性质的实验装置,向装
置中缓慢地通入气体A若关闭活塞,则品红溶液无变
化而澄清石灰水浑浊;若打开活塞,则品红溶液湿色, Y 品红 石灰水
据此判断气体A和洗气瓶内溶液Y分别可能是( )
|
|
A |
B |
C |
D |
|
A |
SO2 |
H2S |
CO2 |
Cl2 |
|
Y |
饱和NaHCO3 |
浓硫酸 |
Na2SO3溶液 |
Na2CO3溶液 |
10.A气体的水溶液呈酸性,若A通入酸性kMnO4溶液,则紫红色褪去,若A通入溴水,则橙色褪去,出现浑浊。A气体是( )
A.Cl2 B.SO2 C.H2S D.CO2
11.将等物质的量的SO2和SO3(g)混合物通入BaCl2溶液中,其结果正确的是( )
A.只有BaSO4沉淀生成,SO2从溶液中逸出
B.两种气体都被吸收,并有BaSO4沉淀生成
C.两种气体都被吸收,且不产生沉淀
D.产生BaSO4和BaSO3两种沉淀
12.除去SO2中少量的SO3,应将混合气体通入( )
A.装有饱和NaHSO3溶液的洗气瓶 B.装水的洗气瓶
C.装有NaOH溶液的洗气瓶 D.装98.3%的H2SO4的洗气瓶
13.SO2和Cl2的溶液都具有漂白性,若将等物质的量的这两种气体同时作用于含足量水的有色有机物质,可观察到有色物质( )
A.立即褪色 B.慢慢褪色 C.先褪色后复原 D.颜色不褪
14.下列物质中,甲跟乙反应可放出有刺激性气味的气体丙,丙跟苛性钠反应可生成甲,丙也可以被直接氧化成丁,丁熔于水可以生成乙.甲、乙、两种物质分别是( )
(1)Na2S (2)Na2SO3 (3)HCl (4)H2SO4
A.(1)和(3) B.(2)和(3) C.(1)和(4) D.(2)和(4)
15.将H2S和O2的混合气体,在1200的湿度下装入密闭容器中,在高温下使之燃烧,已知全部H2S和O2都参加了反应,反应后恢复到原湿度,测得压强为反应前的3/4,则原混合气体中H2S和O2的物质的量之比为( )
A.1 :1 B.1 :2 C.2 :1 D.3 :2
16.11gFeS和足量的盐酸反应,生成的气体全部被250mL0.5mol/L的NaOH溶液吸收,则生成的盐为( )
A.Na2S B.NaHS C.Na2S和NaHS D.NaOH和Na2S
(六)比较SO2与CO2、SO3
|
|
SO2 |
CO2 |
SO3 |
|
主要物性 |
无色、有刺激性气体、易液化易溶于水(1:40) |
无色、无气味气体能溶于水(1:1) |
无色固体.熔点(16.8℃) |
|
与H2O反应 |
 SO2+H2O H2SO3 中强酸 SO2+H2O H2SO3 中强酸 |
 CO2+H2O H2CO2 CO2+H2O H2CO2
弱酸 |
SO3+H2O==H2SO4 (强酸) |
|
与碱反应 |
  Ca(OH)2 CaSO3↓ Ca(HSO3)2 清液 白 清液 |
  Ca(OH)2 CaCO3↓ Ca(HCO3)2 清液 白↓ 清液 |
SO3+Ca(OH)2==CaSO4(微溶) |
|
紫色石蕊 |
变红 |
变红 |
变红 |
|
品红 |
褪色 |
不褪色 |
不褪色 |
|
鉴定存在 |
能使品红褪色 又能使清石灰变浑浊 |
不能使品红褪色 但能使清石灰水变浑浊 |
|
|
氧化性 |
SO2+2H2S=2S↓+2H2O |
CO2+2Mg
2MgO+C CO2+C 2CO |
|
|
还原性 |
有 |
无 |
|
|
与Na2O2作用 |
Na2O2+SO2==Na2SO4 |
2Na2O2+2CO2==2Na2CO3+O2 |
2Na2+2SO3==2NaSO4+O2↑ |
思考 1.如何检验SO2中是否含有CO2?
2.如何除去CO2中的SO2?



提示:1.气体① ② ③ 说明有CO2
2.除去CO2中的SO2方法:
①通过足量KmnO4溶液吸收除去,后干燥
②通过足量的饱和NaHCO3溶液后干燥
SO2+NaHCO3==NaHSO3+CO2
想一想为何不能用Na2CO3?
(4)H2SO4及SO42-
①H2SO4具有酸的一般通性,而浓H2SO4具有酸的通性外还具有三大物性:
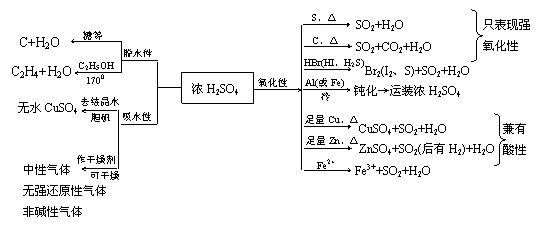

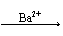 ②SO42-的鉴定
②SO42-的鉴定
一般思路:SO42- BaSO4↓ 沉淀不溶解
干扰离子:主要为Ag+、SO32-.
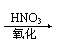
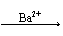 主要原因:若钡盐用BaCl2:Cl-+Ag+==AgCl↓(不溶于强酸)
主要原因:若钡盐用BaCl2:Cl-+Ag+==AgCl↓(不溶于强酸)
若钡盐用Ba(NO3)2:SO32- BaSO3↓ BaSO4↓
 若有沉淀过滤(除Ag+)
若有沉淀过滤(除Ag+)
合理方法:取样
若有气体等其完全释放(除SO32-等)
若有白↓→说明原有SO42-
若无白↓→说明原有SO42-
思考 如何检验Na2SO3样品露置于空气是否变质?是部分还是全部变质?
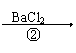
提示:样品 溶液
(1)若①有气体(刺激性)②无沉淀,则尚未被氧化
(2)若①有气体(刺激性)②有沉淀,则部分被氧化
(3)若①无气体放出,②有沉淀,则完全被氧化
(五)比较SO2和Cl2水溶液的漂白性
|
|
SO2 |
Cl2 |
|
漂白原因 |
SO2与H2O反应生成的H2SO3能与某些有色物结合成不稳定无色物 |
Cl2与H2O反应生成HClO具有强氧化性,将有色物氧化成无色物 |
|
漂白效果 |
不稳定,加热能复原 |
稳定 |
|
漂白范围 |
某些有色质 |
绝大多数有机色质 |
|
有机色质 作用实例 |
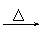  品红 褪色 红色  紫色石蕊 红色 |
  品红 褪色 不显红色  紫色石蕊 先变红随即褪色 |
|
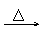
无机有色物 作用实例 |
 溴水 溴水
氯水 SO2 均褪色 KmnO4溶液 还原性 |
 溴水 溴水氯水 Cl2 均不褪色 KmnO4溶液 |
|
混合作用 |
SO2+Cl2+2H2O=H2SO4+2HCl 漂白作用大大减弱 |
(二)比较H2O和H2O2
|
|
H2O |
H2O2 |
|
电子式 |
|
|
|
化学键 |
极性键 |
极性键和非极性键 |
|
分子极性 |
有 |
有 |
|
稳定性 |
 稳定 稳定2H2O 2H2↑+O2↑ |
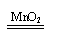 不稳定 不稳定2H2O2 2H2O+O2↑ |
|
氧化性 |
较弱 (遇强还原剂反应) 2Na+2H2O==2NaOH+H2↑ |
较强 (遇还原剂反应) SO2+H2O2===H2SO4 (比较:SO2+H2O H2SO3) |
|
还原性 |
较弱 (遇极强氧化剂反应) 2Fe+2H2O===4HF+O2 |
较强 (遇较强氧化剂反应) 2MnO4-+5H2O2+6H+==2Mn2++5O2↑+8H2O |
|
作用 |
饮用 溶剂等 |
氧化剂、漂白剂 消毒剂、脱氯剂等 |

 测定硫磺的纯度,可采用如下方法:准确称取Wg硫磺,与V1mL C1mol/L NaOH溶液(过量)反应. 6NaOH+4S Na2S2O3+2Na2S+3H2O,直至硫磺完全溶解.冷却至室温,缓缓加入15%的过氧化氢(一种极强的氯化剂、不稳定)溶液至过量 ,并不断摇动,此时发生的反应:
测定硫磺的纯度,可采用如下方法:准确称取Wg硫磺,与V1mL C1mol/L NaOH溶液(过量)反应. 6NaOH+4S Na2S2O3+2Na2S+3H2O,直至硫磺完全溶解.冷却至室温,缓缓加入15%的过氧化氢(一种极强的氯化剂、不稳定)溶液至过量 ,并不断摇动,此时发生的反应: 右图是检验某物质某项性质的实验装置,打开分液
右图是检验某物质某项性质的实验装置,打开分液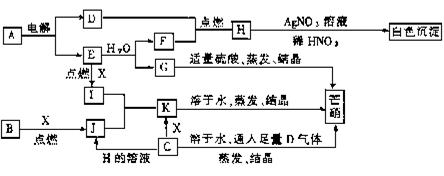
 V
V =
= (2b-a)L.
(2b-a)L.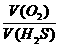 =
=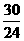 =
= <
<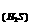 =
=
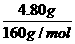 =0.03mol
=0.03mol =0.04mol
=0.04mol =0.01mol
=0.01mol FeS
FeS
 s
s Cu2S
s
s Cu2S