网址:http://m.1010jiajiao.com/timu3_id_350019[举报]
实验题
(1)烧碱在保存过程会部分变质(杂质主要为Na2CO3)。
准确称取5.0g样品配制成250mL溶液,各取配制好的烧碱溶液10.00mL于锥形瓶中,分别向锥形瓶中各加入1~2滴酚酞指示剂,(已知:酚酞变色时,此时只有NaOH与HCl反应,Na2CO3还没有与HCl反应)用浓度为0.20mol·L-1的盐酸标准液进行滴定。相关数据记录如下:
|
实验编号 |
V(烧碱溶液)/mL |
V(盐酸)/mL |
|
|
初始读数 |
末尾读数 |
||
|
1 |
10.00 |
0.50 |
21.52 |
|
2 |
10.00 |
1.00 |
21.98 |
|
3 |
10.00 |
0.20 |
24.80 |
试回答:
①滴定时右手的正确操作是______________________________________。
②判断到达滴定终点的实验现象是__________________________________________,依据表中数据,计算出烧碱样品中含NaOH的质量分数为______ _%。
③下列操作会导致烧碱样品中NaOH含量测定值偏高的是__________。
A.锥形瓶用蒸馏水洗后未用待测液润洗
B.酸式滴定管用蒸馏水洗后未用标准液润洗
C.滴定过程中振荡锥形瓶时,有少量待测溶液溅出
D.滴定前平视读数,滴定结束仰视读数
(2)氧化还原滴定实验同中和滴定类似。过氧化氢是重要的氧化剂,它的水溶液又称为双氧水,常用作消毒、杀菌、漂白等。某化学兴趣小组取一定量的过氧化氢溶液,准确测定了过氧化氢的浓度。已知:2KMnO4+5H2O2+6H2SO4===2MnSO4+8H2O+5O2↑,请填写下列空白:
①用 (填“酸式”或“碱式”)滴定管移取过氧化氢溶液25.00 mL至锥形瓶中,作被测试样。
②滴定时,将高锰酸钾标准溶液注入酸式滴定管中,高锰酸钾标准溶液用酸式滴定管原因为 。③重复滴定三次,平均耗用c mol/L KMnO4标准溶液V mL,则原过氧化氢溶液中过氧化氢的物质的量浓度为 。
查看习题详情和答案>>
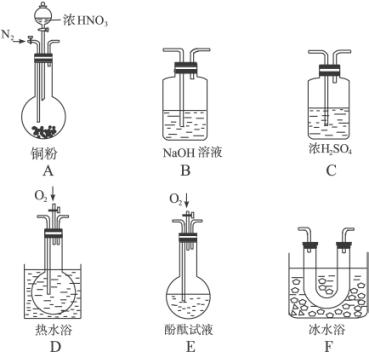
(1)现有甲、乙、丙三位同学分别设计了以下三个实验方案(用仪器连接顺序表示)。
甲:A→C→F→D→B
乙:A→B→C→E
丙:A→E→D→B
甲、乙、丙三位同学提出的实验方案是否能验证Cu与适量浓HNO3反应产生的气体中含有NO?
甲:_________;乙:_________;丙:_________。(填“能”或“不能”)
具体说明不能验证的主要原因(若三个实验方案都能验证,则此小题不用回答):
甲方案:___________________________________________;
乙方案:___________________________________________;
丙方案:___________________________________________。
(2)反应前先通入足量的N2,其目的是_______________________________________。
(3)确认气体中含有NO的现象是:__________________________________________。
(4)如果O2过量,则装置B中发生反应的离子方程式是:__________________________。
查看习题详情和答案>>已知:①NO+NO2+2OH-====2![]() +H2O;气体液化温度:NO2为21 ℃;NO为-152 ℃。
+H2O;气体液化温度:NO2为21 ℃;NO为-152 ℃。
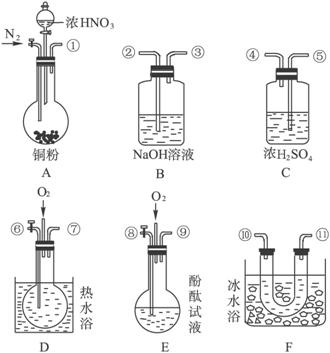
试完成下列问题:
(1)现有甲、乙、丙三位同学分别设计了以下三个实验方案(用仪器的连接顺序表示)。
甲:A→C→F→D→B;乙:A→B→C→E;丙:A→F→D→B;甲、乙、丙三位同学提出的实验方案是否能验证Cu与适量浓硝酸反应产生的气体中含有NO?
甲________;乙________;丙________。(填“能”或“不能”)具体说明不能验证的主要原因(若三个实验方案都能验证,则此小题不用回答)。
(2)反应前先通入足量的N2,其目的是_________________________________。
(3)确认气体中含有NO的现象是______________________________________。
(4)如果O2过量,则装置B中发生反应的化学方程式是_______________________________。
查看习题详情和答案>>已知:①NO+NO2+2OH-![]() 2
2![]() +H2O
+H2O
②气体液化温度:NO2:

(1)现有甲、乙、丙三位同学分别设计了以下三个实验方案(用仪器的连接顺序表示)。
甲:A→C→F→D→B 乙:A→B→C→E 丙:A→F→D→B
甲、乙、丙三位同学提出的实验方案是否能验证Cu与适量浓HNO3反应产生的气体中含有NO(填“能”或“不能”)
甲:_________;乙:_________;丙:_________。
用化学方程式表示不能验证的主要原因(若三个实验方案都能验证,则此小题不用回答):
甲方案:____________________________________;
乙方案:____________________________________;
丙方案:____________________________________。
(2)实验开始时首先通入足量的N2,其目的是:___________________________。
(3)确认气体中含NO的现象是:___________________________。
(4)如果O2过量,则装置B中发生反应的离子方程式是:_____________________________。
查看习题详情和答案>>已知:①NO + NO2 + 2OH-=2NO2-+H2O ②气体液化温度:NO2:21℃、NO:-152℃
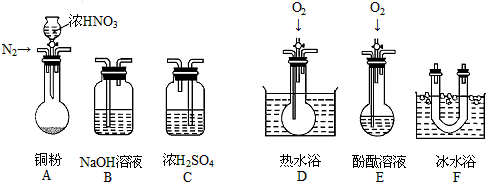
甲:A→C→F→D→B 乙:A→B→C→E 丙:A→F→D→B
甲、乙、丙三位同学提出的实验方案是否能验证Cu与适量浓HNO3反应产生的气体中含有NO(填“能”或“不能”)甲:________;乙:________;丙:_________ 用化学方程式表示不能验证的主要原因(若三个实验方案都能验证,则此小题不用回答):
甲方案:_______________________________
乙方案:_______________________________
丙方案:_______________________________
(2)实验开始时首先通入足量的N2,其目的是:_______________________________。
(3)确认气体中含NO的现象是:______________________________________________。
(4)如果O2过量,则装置B中发生反应的离子方程式是:__________________________。