网址:http://m.1010jiajiao.com/timu3_id_350013[举报]
(1)白磷(P4)可由Ca3(PO4)2、焦炭和SiO2 在一定条件下反应获得.相关热化学方程式如下:
2Ca3(PO4)2(s)+10C(s)═6CaO(s)+P4(s)+10CO(g)△H1=+3359.26kJ?mol-1
CaO(s)+SiO2(s)═CaSiO3(s)△H2=-89.61kJ?mol-1
2Ca3(PO4)2(s)+6SiO2(s)+10C(s)═6CaSiO3(s)+P4(s)+10CO(g)△H3
则△H3= kJ?mol-1.
(2)白磷中毒后可用CuSO4溶液解毒,解毒原理可用下列化学方程式表示:
11P4+60CuSO4+96H2O═20Cu3P+24H3PO4+60H2SO4
60molCuSO4能氧化白磷的物质的量是 .
(3)磷的重要化合物NaH2PO4、Na2HPO4和Na3PO4可通过H3PO4与NaOH溶液反应获得,含磷各物种的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与pH的关系如图所示.
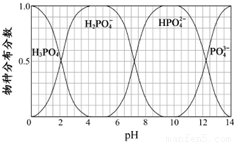
①为获得尽可能纯的NaH2PO4,pH应控制在 ;pH=8时,溶液中主要含磷物种浓度大小关系为 .
②Na2HPO4溶液显碱性,若向溶液中加入足量的CaCl2 溶液,溶液则显酸性,其原因是 (用离子方程式表示).
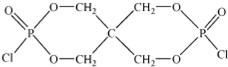
(4)磷的化合物三氯氧磷(
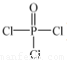 )与季戊四醇(
)与季戊四醇(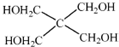 )以物质的量之比2:1 反应时,可获得一种新型阻燃剂中间体X,并释放出一种酸性气体.季戊四醇与X 的核磁共振氢谱如图所示.
)以物质的量之比2:1 反应时,可获得一种新型阻燃剂中间体X,并释放出一种酸性气体.季戊四醇与X 的核磁共振氢谱如图所示.
①酸性气体是 (填化学式).
②X的结构简式为 . 查看习题详情和答案>>
磷是地壳中含量较为丰富的非金属元素,主要以难溶于水的磷酸盐如Ca3(PO4)2等形式存在.它的单质和化合物在工农业生产中有着重要的应用.
(1)白磷(P4)可由Ca3(PO4)2、焦炭和SiO2在一定条件下反应获得.相关热化学方程式如下:2Ca3(PO4)2(s)+10C(s)![]() 6CaO(s)+P4(s)+10CO(g) ΔH1=+3359.26 kJ·mol-1
6CaO(s)+P4(s)+10CO(g) ΔH1=+3359.26 kJ·mol-1
CaO(s)+SiO2(s)![]() CaSiO3(s) ΔH2=-89.61 kJ·mol-1
CaSiO3(s) ΔH2=-89.61 kJ·mol-1
2Ca3(PO4)2(s)+6SiO2(s)+10C(s)![]() 6CaSiO3(s)+P4(s)+10CO(g) ΔH3则ΔH3=________kJ·mol-1.
6CaSiO3(s)+P4(s)+10CO(g) ΔH3则ΔH3=________kJ·mol-1.
(2)白磷中毒后可用CuSO4溶液解毒,解毒原理可用下列化学方程式表示:
11P4+60CuSO4+96H2O![]() 20Cu3P+24H3PO4+60H2SO4
20Cu3P+24H3PO4+60H2SO4
60 mol CuSO4能氧化白磷的物质的量是________.
(3)磷的重要化合物NaH2PO4、Na2HPO4和Na3PO4可通过H3PO4与NaOH溶液反应获得,含磷各物种的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与pH的关系如下图所示.
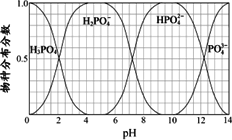
①为获得尽可能纯的NaH2PO4,pH应控制在________;pH=8时,溶液中主要含磷物种浓度大小关系为________.
②Na2HPO4溶液显碱性,若向溶液中加入足量的CaCl2溶液,溶液则显酸性,其原因是________(用离子方程式表示).
(4)磷的化合物三氯氧磷(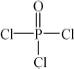 )与季戊四醇(
)与季戊四醇( )以物质的量之比2∶1反应时,可获得一种新型阻燃剂中间体X,并释放出一种酸性气体.季戊四醇与X的核磁共振氢谱如下图所示.
)以物质的量之比2∶1反应时,可获得一种新型阻燃剂中间体X,并释放出一种酸性气体.季戊四醇与X的核磁共振氢谱如下图所示.
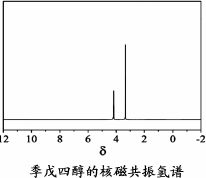
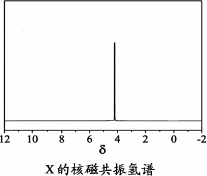
①酸性气体是________(填化学式).
②X的结构简式为________.
(1)白磷(P4)可由Ca3(PO4)2、焦炭和SiO2 在一定条件下反应获得.相关热化学方程式如下:
2Ca3(PO4)2(s)+10C(s)═6CaO(s)+P4(s)+10CO(g)△H1=+3359.26kJ?mol-1
CaO(s)+SiO2(s)═CaSiO3(s)△H2=-89.61kJ?mol-1
2Ca3(PO4)2(s)+6SiO2(s)+10C(s)═6CaSiO3(s)+P4(s)+10CO(g)△H3
则△H3=
(2)白磷中毒后可用CuSO4溶液解毒,解毒原理可用下列化学方程式表示:
11P4+60CuSO4+96H2O═20Cu3P+24H3PO4+60H2SO4
60molCuSO4能氧化白磷的物质的量是
(3)磷的重要化合物NaH2PO4、Na2HPO4和Na3PO4可通过H3PO4与NaOH溶液反应获得,含磷各物种的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与pH的关系如图所示.

①为获得尽可能纯的NaH2PO4,pH应控制在
②Na2HPO4溶液显碱性,若向溶液中加入足量的CaCl2 溶液,溶液则显酸性,其原因是
(4)磷的化合物三氯氧磷(
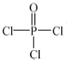 )与季戊四醇(
)与季戊四醇(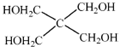 )以物质的量之比2:1 反应时,可获得一种新型阻燃剂中间体X,并释放出一种酸性气体.季戊四醇与X 的核磁共振氢谱如图所示.
)以物质的量之比2:1 反应时,可获得一种新型阻燃剂中间体X,并释放出一种酸性气体.季戊四醇与X 的核磁共振氢谱如图所示.
①酸性气体是
②X的结构简式为

(1)常温下,取pH=2的盐酸和醋酸溶液各100mL,向其中分别加入适量的Zn粒,反应过程中两溶液的pH变化如图所示.则图中表示醋酸溶液中pH变化曲线的是______(填”A”或”B”).设盐酸中加入的Zn质量为m1,醋酸溶液中加入的Zn质量为m2.则m1______m2.(选填”<“、”=“或”>“)
(2)在体积为3L的密闭容器中,CO与H2在一定条件下反应生成甲醇:CO(g)+2H2(g)?CH3OH(g).该反应的平衡常数表达式K=______,升高温度,K值______(填”增大”“减小”或”不变”).在500℃,从反应开始到平衡,氢气的平均反应速率v(H2)=______.
(3)难溶电解质在水溶液中存在着溶解平衡.在某温下,溶液里各离子浓度以它们化学计量数为方次的乘积是一个常数,叫溶度积常数.例如:Mg(OH)2(s)?Mg2+ (aq)+2OH- (aq),某温度下Ksp=c(Mg2+)[c(OH-)]2=2×10-11.若该温度下某MgSO4溶液里c(Mg2+)=0.002mol?L-1,如果生成Mg(OH)2沉淀,应调整溶液pH,使之大于______;该温度下,在0.20L的0.002mol?L-1MgSO4溶液中加入等体积的0.10mol?L-1的氨水溶液,该温度下电离常数K(NH3?H2O)=2×10-5,经计算______(填”有”或”无”)Mg(OH)2沉淀生成.
(4)常温下,向某纯碱(Na2CO3)溶液中滴入酚酞,溶液呈红色,则该溶液呈______性.在分析该溶液遇酚酞呈红色的原因时,甲同学认为是配制溶液所用的纯碱样品中混有NaOH所致;乙同学认为是溶液中Na2CO3电离出的C
| O | 2-3 |

(1)常温下,取pH=2的盐酸和醋酸溶液各100mL,向其中分别加入适量的Zn粒,反应过程中两溶液的pH变化如图所示.则图中表示醋酸溶液中pH变化曲线的是 (填”A”或”B”).设盐酸中加入的Zn质量为m1,醋酸溶液中加入的Zn质量为m2.则m1 m2.(选填”<“、”=“或”>“)
(2)在体积为3L的密闭容器中,CO与H2在一定条件下反应生成甲醇:CO(g)+2H2(g)?CH3OH(g).该反应的平衡常数表达式K= ,升高温度,K值 (填”增大”“减小”或”不变”).在500℃,从反应开始到平衡,氢气的平均反应速率v(H2)= .
(3)难溶电解质在水溶液中存在着溶解平衡.在某温下,溶液里各离子浓度以它们化学计量数为方次的乘积是一个常数,叫溶度积常数.例如:Mg(OH)2(s)?Mg2+ (aq)+2OH- (aq),某温度下Ksp=c(Mg2+)[c(OH-)]2=2×10-11.若该温度下某MgSO4溶液里c(Mg2+)=0.002mol?L-1,如果生成Mg(OH)2沉淀,应调整溶液pH,使之大于 ;该温度下,在0.20L的0.002mol?L-1MgSO4溶液中加入等体积的0.10mol?L-1的氨水溶液,该温度下电离常数K
 ,经计算 (填”有”或”无”)Mg(OH)2沉淀生成.
,经计算 (填”有”或”无”)Mg(OH)2沉淀生成.(4)常温下,向某纯碱(Na2CO3)溶液中滴入酚酞,溶液呈红色,则该溶液呈 性.在分析该溶液遇酚酞呈红色的原因时,甲同学认为是配制溶液所用的纯碱样品中混有NaOH所致;乙同学认为是溶液中Na2CO3电离出的
 水解所致.请你设计一个简单的实验方案给甲和乙两位同学的说法以评判(包括操作、现象和结论).
水解所致.请你设计一个简单的实验方案给甲和乙两位同学的说法以评判(包括操作、现象和结论). 查看习题详情和答案>>
查看习题详情和答案>>