摘要:400mL0.500mol L-1的NaOH溶液中通入一定量的SO2气体.然后在低温下蒸发溶液.得到白色固体A. (1)推测此白色固体A所有可能的组成.将其化学式填入下表. 编 号 ① ② ③ ④ 组成A的物质 的化学式 (2)若A的质量为16.7g.通过计算确定A的物质组成及其质量. 秋学期第一次质量抽测 高三化学答案卷 命题人:马罗平
网址:http://m.1010jiajiao.com/timu3_id_341347[举报]
如图所示:甲、乙为相互串联的两电解池.试回答:
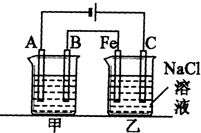
(1)乙池反应中C极产物的检验方法为:
(2)甲池若为用电解原理精炼铜的装置,则A电极名称为
查看习题详情和答案>>

(1)乙池反应中C极产物的检验方法为:
利用湿润的淀粉碘化钾试纸变蓝检验
利用湿润的淀粉碘化钾试纸变蓝检验
,乙池中Fe极电极反应式为2H++2e-═H2↑
2H++2e-═H2↑
,若在乙池中滴入少量酚酞试液,开始电解一段时间,铁极附近呈变红
变红
色,原因是:溶液中氢离子得到电子生成氢气,破坏水的电离平衡,氢氧根离子浓度增大显碱性
溶液中氢离子得到电子生成氢气,破坏水的电离平衡,氢氧根离子浓度增大显碱性
.(2)甲池若为用电解原理精炼铜的装置,则A电极名称为
阴
阴
极,电极材料是纯铜
纯铜
,电极反应式为Cu2++2e-═Cu
Cu2++2e-═Cu
,电解质溶液可以是含铜离子的盐溶液
含铜离子的盐溶液
.若甲池A极增重12.8g,则乙池C(石墨)极放出气体在标况下的体积为4.48L
4.48L
.电解后,若乙池剩余溶液为400mL,则溶液的pH=14
14
. 如图为相互串联的甲乙两个电解池,请回答:
如图为相互串联的甲乙两个电解池,请回答:(1)甲池若为用电解原理给铁片镀铜的装置,电镀液为
可溶性铜盐溶液
可溶性铜盐溶液
,待镀的铁片作
阴
阴
极(填“阴”“阳”),为图中的A
A
极(填“A”“B”);(2)乙池中若滴入少量酚酞试液,开始一段时间后,Fe极附近呈
红
红
色;(3)若甲槽阴极增重12.8g,则乙槽阳极放出气体在标准状况下的体积为
4.48L
4.48L
;(4)若乙槽剩余液体为400mL,则电解后得到碱液的物质的量浓度为
1mol?L-1
1mol?L-1
,pH为14
14
. 如图为相互串联的甲乙两个电解池,请回答:
如图为相互串联的甲乙两个电解池,请回答:(1)甲池若为用电解原理精炼铜的装置,A极是
阴极
阴极
,材料是精铜
精铜
,电极反应为Cu2++2e-=Cu
Cu2++2e-=Cu
;B极是阳极
阳极
,材料是粗铜
粗铜
,主要电极反应为Cu-2e-=Cu2+
Cu-2e-=Cu2+
,电解质溶液为CuSO4溶液
CuSO4溶液
.(2)乙池中若滴入少量酚酞试液,开始一段时间后,
Fe
Fe
极附近呈红色.(3)若甲槽阴极增重12.8g,则乙槽阳极放出气体在标准状况下的体积为
4.48L
4.48L
.(4)常温下若乙槽剩余液体为400mL,则电解后得到碱液的物质的量浓度为
1mol/L
1mol/L
. 如图所示:甲、乙为相互串联的两电解池.试回答:
如图所示:甲、乙为相互串联的两电解池.试回答:(1)乙池中Fe极电极反应式为
2H++2e-═H2↑
2H++2e-═H2↑
,若在乙池中滴入少量酚酞试液,开始电解一段时间,铁极附近呈红
红
色.(2)甲池若为用电解原理精炼铜(假设粗铜的组成是均匀的,且比其活泼和不活泼的成分均存在)的装置,则A电极材料为
精铜
精铜
,电极反应式为Cu2++2e-═Cu
Cu2++2e-═Cu
,电解质溶液可以是CuSO4
CuSO4
;通电一段时间后,A极增重12.8g,则甲池溶液原溶质的浓度减小
减小
(填“增大”、“减小”、“不变”或“无法确定”),乙池C(石墨)极放出气体在标准状况下的体积为4.48
4.48
L,此时乙池剩余溶液的体积为400mL,则溶液的c(OH-)1mol/L
1mol/L
.若要使乙池溶液恢复到电解前的状态,可向溶液中加入HCl
HCl
(填写物质的化学式)14.6
14.6
g.液氯储罐中常混有NCl3,当液氯中NCl3的质量分数达到4%以上就有爆炸危险.
(1)NCl3易水解生成一种碱性气体和一种具有漂白性的物质.写出该反应的化学方程式 .
(2)为测定氯气中的NCl3含量,将一定量样品先通过足量盐酸吸收NCl3(反应为:NCl3+4HCl→NH4Cl+3Cl2),再用400mL 20.0%(ρ=1.22g/cm3)的工业NaOH溶液吸收所有的Cl2,测得吸收后NaOH溶液增重51.4g.经测定NCl3吸收管内NH4+质量为0.270g.
①上述工业NaOH溶液的物质的量浓度为 .
②计算该样品中NCl3的质量分数,并判断该样品是否安全?
(3)一般情况下,较强的氧化剂如:MnO2、KMnO4、KClO3、Ca(ClO)2等氧化浓盐酸时,有如下反应规律:氧化剂+浓盐酸→金属氯化物+水+氯气.实验室通常用该原理制取少量Cl2.
①将214.5g Ca(ClO)2放入500mL 12.0mol/L的浓盐酸中,生成的Cl2在标准状况下的体积为39.2L.若反应前后溶液的体积保持不变,计算反应后溶液中HCl的物质的量浓度.
②漂白粉是 Ca(ClO)2、CaCl2、Ca(OH)2、H2O和CaO的混合物.漂白粉放出的氯气具有漂白作用,叫有效氯.通常用有效氯表示漂白粉的纯度.漂白粉中的有效氯含量常用滴定碘法进行测定,即在一定量的漂白粉中加入过量的KI,加H2SO4酸化,有效氯与I-作用析出等量的I2,析出的I2以淀粉指示剂立即用Na2S2O3标准溶液滴定.若测定漂白粉中有效氯时用盐酸酸化,则盐酸的浓度应小于 mol/L,否则测定的有效氯将 (选填“偏高”、“偏低”或“不变”).
查看习题详情和答案>>
(1)NCl3易水解生成一种碱性气体和一种具有漂白性的物质.写出该反应的化学方程式
(2)为测定氯气中的NCl3含量,将一定量样品先通过足量盐酸吸收NCl3(反应为:NCl3+4HCl→NH4Cl+3Cl2),再用400mL 20.0%(ρ=1.22g/cm3)的工业NaOH溶液吸收所有的Cl2,测得吸收后NaOH溶液增重51.4g.经测定NCl3吸收管内NH4+质量为0.270g.
①上述工业NaOH溶液的物质的量浓度为
②计算该样品中NCl3的质量分数,并判断该样品是否安全?
(3)一般情况下,较强的氧化剂如:MnO2、KMnO4、KClO3、Ca(ClO)2等氧化浓盐酸时,有如下反应规律:氧化剂+浓盐酸→金属氯化物+水+氯气.实验室通常用该原理制取少量Cl2.
①将214.5g Ca(ClO)2放入500mL 12.0mol/L的浓盐酸中,生成的Cl2在标准状况下的体积为39.2L.若反应前后溶液的体积保持不变,计算反应后溶液中HCl的物质的量浓度.
②漂白粉是 Ca(ClO)2、CaCl2、Ca(OH)2、H2O和CaO的混合物.漂白粉放出的氯气具有漂白作用,叫有效氯.通常用有效氯表示漂白粉的纯度.漂白粉中的有效氯含量常用滴定碘法进行测定,即在一定量的漂白粉中加入过量的KI,加H2SO4酸化,有效氯与I-作用析出等量的I2,析出的I2以淀粉指示剂立即用Na2S2O3标准溶液滴定.若测定漂白粉中有效氯时用盐酸酸化,则盐酸的浓度应小于